题目内容
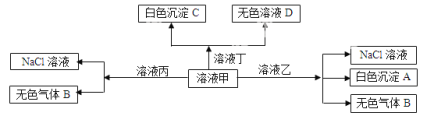
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
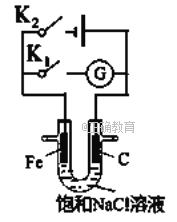
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
【答案】B
【解析】A、K1闭合构成原电池,铁是活泼的金属,铁棒是负极,铁失去电子,铁棒上发生的反应为Fe+2e-=Fe2+,A不正确;B、K1闭合构成原电池,铁棒是负极,铁失去电子,石墨棒是正极,溶液中的氧气得到电子转化为OH-,电极反应式为O2+4e-+2H2O=40H-,石墨棒周围溶液pH逐渐升高,B正确;C、K2闭合构成电解池,铁棒与电源的负极相连,作阴极,溶液的氢离子放电产生氢气,铁不会被腐蚀,属于外加电流的阴极保护法,C不正确;D、K2闭合构成电解池,铁棒与电源的负极相连,作阴极,溶液中的氢离子放电生成氢气。石墨棒是阳极,溶液中的氯离子放电生成氯气,电极反应式分别为2H++2e-=H2↑、2Cl--2e-=Cl2↑,电路中通过0.002NA个电子时,两极均产生0.001mol气体,共计是0.002mol气体,D不正确,答案选B。
点晴:本题通过电解饱和氯化钠溶液为载体,重点考查原电池和电解池的判断,金属的腐蚀与防护以及电极产物判断和计算,意在考查学生分析问题、解决问题的能力。熟练掌握电化学原理,准确判断正、负极以及阴、阳极,明确两极的电极反应及电池反应是解题的关键。该类试题的难点在于是电极反应式的书写和有关计算。

 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】
不同方案 | 所选幼苗状况及分组 | 幼苗的培养液(基) | 实验中光照条件 |
A | 长势相同幼苗分成两组 | 一组用清水培养,一组用镁溶液培养 | 充足光照 |
B | 长势不同幼苗分成两组 | 一组提供完全培养液,一组提供只缺镁的培养液 | 充足光照 |
C | 长势相同幼苗分成两组 | 一组提供完全配液,一组提供只缺镁的培养液 | 充足光照 |
D | 长势相同幼苗分成两组 | 一组用普通土壤培养,一组用加镁土壤培养 | 充足光照 |
A.A B.B C.C D.D
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 浓盐酸 |
③ | FeCl3溶液 | Cu | 浓硝酸 |
④ | O2 | N2 | H2 |
A. ①③ B. ①④ C. ②④ D. ②③