题目内容
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
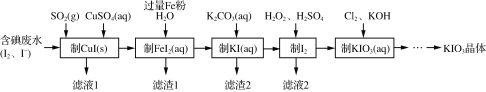
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是________。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为__________________________________。
(3)滤渣1的成分为________。

(4)“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。已知此温度下,Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。现测得溶液中c(FeI2)为0.9 mol·L-1,为减少I-的损失,起始时,加入K2CO3必须保持FeI2溶液的pH不大于________。
(5)“制KIO3溶液”时,发生反应的离子方程式为_______________________________。
(6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为___________________。
【答案】淀粉溶液 SO2+I2+2H2O===SO42-+2I-+4H+(或2SO2+I2+2Cu2++4H2O===2CuI↓+2SO42-+8H+) Fe、Cu 6.0 5Cl2+I2+12OH-===2IO3-+10Cl-+6H2O 蒸发浓缩,降温结晶
【解析】
由流程图可知,含碘废水通入SO2将I2还原为I-,Cu2+和I-发生反应生成CuI和I2,总反应为2SO2+I2+2Cu2++4H2O===2CuI↓+2SO42-+8H+,过滤后得到CuI固体;向CuI固体中加入Fe粉和水置换出铜并生成FeI2溶液,过滤后得到滤渣为过量的铁和生成的铜;向FeI2溶液中加入K2CO3溶液制取KI;在KI溶液中加入H2O2和H2SO4,将I-氧化为I2;I2和Cl2在碱性条件下反应生成KIO3,KIO3溶液通过蒸发浓缩,降温结晶得到KIO3晶体。
(1)碘与淀粉溶液变蓝,所以检验I2,常用的试剂是淀粉溶液,
故答案为:淀粉溶液;
(2)SO2将I2还原为I-,本身被氧化为SO42-,离子方程式为SO2+I2+2H2O===SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O===SO42-+2I-+4H+;
(3)根据以上分析,滤渣1的成分为Fe、Cu,
故答案为:Fe、Cu;
(4)Fe2+会水解形成胶状物吸附KI,造成I-的损失,为减少I-的损失,防止生成Fe(OH)2,需要控制溶液的pH,根据Ksp[Fe(OH)2]=c(Fe2+)![]() c2(OH-)=9.0×10-15,得c(OH-)=
c2(OH-)=9.0×10-15,得c(OH-)=![]() =10-7mol/L,则c(H+)=
=10-7mol/L,则c(H+)=![]() =1.0
=1.0![]() 10-6mol/L,pH=-lg10-6=6.0,
10-6mol/L,pH=-lg10-6=6.0,
即加入K2CO3必须保持FeI2溶液的pH不大于6.0,
故答案为:6.0;
(5) I2和Cl2在碱性条件下反应生成KIO3,离子方程式为5Cl2+I2+12OH-===2IO3-+10Cl-+6H2O ,
故答案为:5Cl2+I2+12OH-===2IO3-+10Cl-+6H2O ;
(6) 由溶解度曲线可知KIO3在常温下的溶解度较小,故由KIO3溶液得到KIO3晶体的方法为蒸发浓缩,降温结晶,
故答案为:蒸发浓缩,降温结晶。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________。

②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:

由此推测,实验Ⅱ“红色明显变浅”的原因是___________________。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______。






