题目内容
【题目】下列说法正确的是( )
A.国产大飞机C919用到的氮化硅陶瓷属于新型无机非金属材料
B.用pH试纸测得氯水的pH为2
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.铝和重氢氧化钠的![]() 溶液反应的化学方程式:2Al+2NaOD+2
溶液反应的化学方程式:2Al+2NaOD+2![]() 2O=2NaAlO2+D2↑+
2O=2NaAlO2+D2↑+![]() 2↑
2↑
【答案】A
【解析】
A.国产大飞机C919用到的氮化硅陶瓷属于新型无机非金属材料,A正确;
B.氯水中含有次氯酸,具有强氧化性,可氧化指示剂,则不能用pH试纸测得氯水的pH,B错误;
C.CO、NO、NO2都是大气污染气体,NO与空气中的氧气反应,在空气中不能稳定存在,C错误;
D.铝和氢氧化钠溶液的反应分两步进行:首先铝和水发生置换反应:2Al+6![]() 2O=2Al(O
2O=2Al(O![]() )3+3
)3+3![]() 2↑,生成的Al(O
2↑,生成的Al(O![]() )3再和重氢氧化钠反应:Al(O
)3再和重氢氧化钠反应:Al(O![]() )3+NaOD=NaAlO2+
)3+NaOD=NaAlO2+![]() O+
O+![]() ,D错误;
,D错误;
答案为A。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】利用图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
C | 浓硫酸 | 乙醇 | KMnO4 | 发生消去反应生成乙烯 | |
D | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
A. AB. BC. CD. D
【题目】运用化学反应原理对研究部分单质及其化合物的反应有重要意义。
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)![]() 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知H—H键键能为436kJ·mol-1,N≡N键键能为945 kJ·mol-1,N—H键键能为391 kJ·mol-1。由键能计算消耗1 mol N2时的ΔH=_____。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡____(填“向左”、“向右”或“不”)移动。
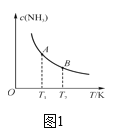
②如图中,当温度由T1变化到T2时,KA___(填“>”、“<”或“=”)KB。
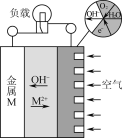
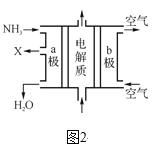
③废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作____(填“正”、“负”、“阴”或“阳”)极,其电极反应式为____。
(2)某温度下在容积固定的密闭容器中,下列反应达到平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始n(CO)∶n(H2O) | CO转化率 | H2O转化率 |
1∶1 | 0.5 | 0.5 |
1∶2 | 0.67 | 0.33 |
1∶3 | 0.75 | 0.25 |
①该反应的平衡常数为_____。该温度下,向容器中充入1 mol CO、3 mol H2O、2 mol CO2、1.5 mol H2,则起始时该反应速率v(正)______(填“>”、“<”或“=”)v(逆)。
②结合表中数据,判断下列说法正确的是_______(填字母)。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1∶4时,CO的转化率为0.85
③该温度下,向容器中充入2 mol CO、2 mol H2O,达平衡时放出a kJ热量,则该反应的ΔH=_____。
【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是____________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式 _______________________________。
(3)只由④形成的18电子微粒的电子式 _______________。
(4)写出由①和③形成的离子化合物的化学式 ____________________________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程_________________________________。
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 _________________。