题目内容
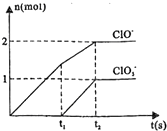 已知NaOH与Cl2反应的氧化产物与温度有关(发生的反应均为放热反应),在V L 4mol/L的NaOH中通入一定量的氯气,生成物中含有Cl-、ClO-、ClO3-三种含氯元素的离子,其中C1O-、ClO3-的物质的量(n)与反应时间(t)的曲线如图所示.
已知NaOH与Cl2反应的氧化产物与温度有关(发生的反应均为放热反应),在V L 4mol/L的NaOH中通入一定量的氯气,生成物中含有Cl-、ClO-、ClO3-三种含氯元素的离子,其中C1O-、ClO3-的物质的量(n)与反应时间(t)的曲线如图所示.(1)若t2时刻恰好反应完全,则V=
(2)工业上常用ClO-氧化处理含CN-(其中C为+2价)的废水,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:aCN-+bClO-+2cOH-═dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述化学方程式可能的配平系数有多组,方程式中e:f的值为
A.1 B.
| 1 |
| 2 |
考点:离子方程式的有关计算
专题:计算题,卤族元素
分析:(1)由图可知n(ClO-)=2mol,n(ClO3-)=1mol,由得失电子守恒可知n(Cl-)=5n(ClO3-)+n(ClO-)=5×1+1×2=7mol,因为恰好完全反应生成NaCl、NaClO、NaClO3,由组成守恒,可知n(NaOH)=n(Cl-)+n(ClO3-)+n(ClO-)=7+1+2=10mol,再由V=
=
=2.5L;
(2)由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2.
| n |
| C |
| 10mol |
| 4mol/L |
(2)由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2.
解答:
解:(1)由图可知n(ClO-)=2mol,n(ClO3-)=1mol,由得失电子守恒可知n(Cl-)=5n(ClO3-)+n(ClO-)=5×1+1×2=7mol,因为恰好完全反应生成NaCl、NaClO、NaClO3,由组成守恒,可知n(NaOH)=n(Cl-)+n(ClO3-)+n(ClO-)=7+1+2=10mol,再由V=
=
=2.5L,故答案为:2.5;
(2)由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,故选B.
| n |
| C |
| 10mol |
| 4mol/L |
(2)由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,以因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,故选B.
点评:本题考查了氧化还原反应的计算,明确该反应中的生成物是解本题关键,结合原子守恒、转移电子守恒来分析解答,题目难度中等.

练习册系列答案
相关题目
如果25℃时KW=1×10-14,t℃(t>25)时KW=1×10-12,这说明( )
| A、t℃时水的电离程度较大 |
| B、前者c(H+)较后者大 |
| C、水的电离过程是一个放热过程 |
| D、KW和T(温度)无直接关系 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、1.8g NH4+中含有的质子数为NA |
| B、标准状况下,2.24L CO2和SO2混合气中氧原子数为0.1NA |
| C、12g Mg与足量盐酸反应时,失去的电子数为NA |
| D、100mL 1mol?L-1的醋酸溶液中,CH3COO-离子数为0.1NA |
 如图乙酸与乙醇在浓硫酸存在的条件下加热,反应生成乙酸乙酯.完成下列填空:
如图乙酸与乙醇在浓硫酸存在的条件下加热,反应生成乙酸乙酯.完成下列填空: