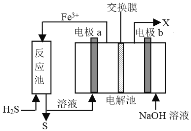
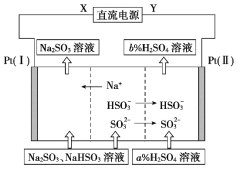
��Ŀ����
����Ŀ�����û�ѧ��Ӧԭ���о�̼�����ĵ��ʼ��仯����ķ�Ӧ�Ի������Ⱦ����ԴΣ��������Ҫ���塣
(1)��Ӧ��Fe(s)��CO2(g) ![]() FeO(s)��CO(g)����H1��ƽ�ⳣ��ΪK1��
FeO(s)��CO(g)����H1��ƽ�ⳣ��ΪK1��
��Ӧ��Fe(s)��H2O(g) ![]() FeO(s)��H2(g)����H2��ƽ�ⳣ��ΪK2��
FeO(s)��H2(g)����H2��ƽ�ⳣ��ΪK2��
�ڲ�ͬ�¶�K1��K2ֵ���±���
700 �� | 900 �� | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
���ɱ����жϣ���Ӧ��Ϊ����H1______ (����<������=������>��) 0��
�ڷ�ӦCO2(g)��H2(g) ![]() CO(g)��H2O(g)����Hƽ�ⳣ��ΪK����K��________(��K1��K2��ʾ)��
CO(g)��H2O(g)����Hƽ�ⳣ��ΪK����K��________(��K1��K2��ʾ)��
�����ж�CO2(g)��H2(g) ![]() CO(g)��H2O(g)�ﵽ��ѧƽ��״̬��������________(����ĸ)��
CO(g)��H2O(g)�ﵽ��ѧƽ��״̬��������________(����ĸ)��
A.������ѹǿ���� B.���������c(CO)����
C.v��(H2)��v��(H2O) D.c(CO)��c(CO2)
E.�����ڵ������ܶȲ��� F.��������ƽ��Ħ���������䡣
(2)�ڲ�ͬ�¶Ⱥ�ѹǿ�ºϳɰ�����ʼʱͶ�뵪�������������ʵ����ֱ�Ϊ1mol��3mol��ƽ��ʱ������а�������������¶ȵĹ�ϵ��ͼ��
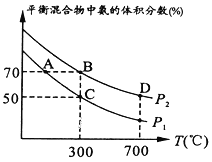
��P1_______P2 (����>����=�� ��<��������ȷ������)��
��C��H2��ת����Ϊ________��
���𰸡�> ![]() BC < 66.7��
BC < 66.7��
��������
(1)�����û�ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬��Ũ���أ�Ȼ�������¶ȶԻ�ѧƽ���ƶ�Ӱ����з�����
�����û�ѧƽ�ⳣ������ʽ���з�����
�����û�ѧƽ��״̬�Ķ�����з�����
(2)�����õ����£�ѹǿ�Ի�ѧƽ���ƶ���Ӱ����з�����
�����á�����ʽ�������м��㣻
(1)�ٸ��ݱ��������ݣ��¶����ߣ�K1����˵�������¶ȣ�ƽ��������Ӧ�����ƶ�������H1>0��
�ڸ��ݻ�ѧƽ�ⳣ���Ķ��壬K1=![]() ��K2=
��K2=![]() ��K=
��K=![]() ,�Ƴ�K=
,�Ƴ�K=![]() ��
��
��A. �÷�Ӧ���ص㣺��Ӧǰ������ϵ��֮����ȣ�����Ӧǰ���������ʵ������䣬�Ӷ��Ƴ�ѹǿ���䣬����˵����Ӧ�ﵽƽ�⣬��A���������⣻
B. ���ݻ�ѧƽ��״̬�Ķ��壬��c(CO)���ٸı䣬˵����Ӧ�ﵽƽ�⣬��B�������⣻
C. v��(H2)��ʾ������Ӧ������У�v��(H2O)��ʾ���淴Ӧ������У���H2��H2O��ϵ����ͬ��v��(H2)��v��(H2O)�ܹ�˵����Ӧ�ﵽƽ�⣬��C�������⣻
D. ͨ������Ũ����ȣ�����˵����Ӧ�ﵽƽ�⣬��D���������⣻
E. ��Ӧǰ������ϵ��֮����ȣ����������������ֲ��䣬��ֶ������壬�������������ֲ��䣬����ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬��E���������⣻
F. ��Ӧǰ������ϵ��֮����ȣ����������ʵ������ֲ��䣬�������������ֲ��䣬���ƽ��Ħ���������䣬����˵����Ӧ�ﵽƽ�⣬��F���������⣻
(2)�ٺϳɰ��ķ�Ӧ����ʽΪN2��3H2 ![]() 2NH3����ͬ�����£�ѹǿԽ��ƽ��������Ӧ������У�NH3�����������P2>P1��
2NH3����ͬ�����£�ѹǿԽ��ƽ��������Ӧ������У�NH3�����������P2>P1��
��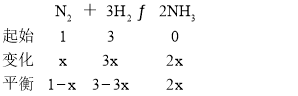 ��C�㰱���������Ϊ
��C�㰱���������Ϊ![]() ��100%=50%�����x=
��100%=50%�����x=![]() ����H2��ת����Ϊ
����H2��ת����Ϊ![]() ��100%��66.7%��
��100%��66.7%��

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�����Ŀ���������������ʵ�Ľ�����ȷ���ǣ� ��
ѡ�� | �������ʵ | ���� |
A | ���ȵĴ�����Һȥ������ | ����������ֱ�ӷ�����Ӧ������������ˮ������ |
B | ʩ��ʱ����ľ��(��Ч�ɷ�ΪK2CO3)������NH4Cl���ʹ�� | K2CO3��NH4Cl��Ӧ���ɰ����ή�ͷ�Ч |
C | Ư���ڿ����о��ñ��� | Ư���е�ClO-����ˮ���HClO |
D | FeCl3��Һ������ˮ���� | FeCl3��Fe3+���������Կ�ɱ������ |
A.AB.BC.CD.D