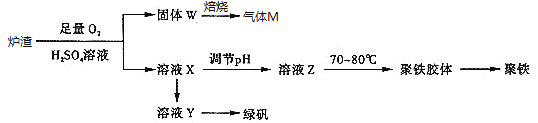
��Ŀ����
����Ŀ�����ᴿ���������ơ�̼����淋��Ȼ��ƹ��壬ijѧ����������·�����

����ݲ������̻ش��������⣺
��1���������ڼ���ʱӦѡ��___ʢװ�����(����������)��
��2�����в����ں��ж�SO42�ѳ�����ȫ�ķ�����___��
��3�������۵Ļ�ѧ����ʽΪ___��
��4�������ܵ�Ŀ����___��
��5��ʵ���ҽ��в����ݵľ��岽����___��
��6��ijͬѧ�����Ƶõ��Ȼ��ƹ�������100mL0.2molL1���Ȼ�����Һ��
������NaCl��Һʱ���õ�����Ҫ������������ƽ��ҩ�ס��ձ�������������Ͳ��__��__��
�����в�����ʹ�����Ȼ�����ҺŨ��ƫС����___(�������)��
A����ˮ����ʱ���ӿ̶���
B������ƿ�ڱڸ���ˮ���δ���ﴦ��
C�����ܽ������������Һ�彦���ձ���
D���ߵ�ҡ�Ⱥ��ְ�Һ����ڿ̶����ּ�ˮ����
���𰸡����� ���ã����ϲ���Һ��ά���μ�BaCl2��Һ���������ֻ��ǣ���SO42-�ѳ�����ȫ BaCl2+Na2CO3=BaCO3��+2NaCl ��ȥ�ܽ�����Һ�й�����HCl��CO2 ����Һ�����������У��������������ò��������Ͻ��裬�����������г��ֽ϶����ʱ��ֹͣ���ȣ����������������ʹ��Һ���� ��ͷ�ι� 100mL����ƿ CD
��������
���������ơ�̼����淋��Ȼ��ƹ��壬�����̿�֪�����з������������·ֽⷴӦ���ֽ��Ĺ�������ˮ�����Ȼ�����Ӧ��ȥ��������ӣ�������̼���Ƴ�ȥ�����ı����ӣ����˺���Һ�к�NaCl��̼���ƣ��������ȥ̼���ƺ�����ΪNaCl�������õ�������NaCl���Դ˽����⡣
��1�����ȹ��壬Ӧ�������н��У��ʴ�Ϊ��������
��2����������Ȼ�����Һ��ȥ��������ӣ����������������ȫ���������жϷ���Ϊȡ�����ں����Һ������һ�Թ��У����ã����ϲ���Һ��ά���μ�BaCl2��Һ���������ֻ��ǣ���SO42�ѳ�����ȫ��
�ʴ�Ϊ�����ã����ϲ���Һ��ά���μ�BaCl2��Һ���������ֻ��ǣ���SO42�ѳ�����ȫ��
��3�������ڷ�����Ӧ�����ӷ���ʽΪBaCl2+Na2CO3=BaCO3��+2NaCl��
��4��������У��ɳ�ȥ�ܽ�����Һ�й�����HCl��CO2���ʴ�Ϊ����ȥ�ܽ�����Һ�й�����HCl��CO2��
��5�����Ȼ�����Һ�õ������Ȼ��ƣ��ɽ���Һ�����������У��������������ò��������Ͻ��裬�����������г��ֽ϶����ʱ��ֹͣ���ȣ����������������ʹ��Һ���ɣ�
�ʴ�Ϊ������Һ�����������У��������������ò��������Ͻ��裬�����������г��ֽ϶����ʱ��ֹͣ���ȣ����������������ʹ��Һ���ɣ�
��6����ʵ��������100mL0.2mol��L1���Ȼ�����Һ��Ӧѡ��100mL������ƿ���õ��������У�������ƽ��ҩ�ס��ձ�������������Ͳ��100mL����ƿ����ͷ�ιܣ�
�ʴ�Ϊ����ͷ�ιܡ�100mL����ƿ��
��A����ˮ����ʱ���ӿ̶��ߣ��������ƫС����Ũ��ƫ��A����
B������ƿ�ڱڸ���ˮ���δ���ﴦ������ʵ����Ӱ�죬��B����
C�����ܽ������������Һ�彦���ձ��⣬�������ʵ����ʵ���ƫС����Ũ��ƫС����C��ȷ��
D���ߵ�ҡ�Ⱥ��ְ�Һ����ڿ̶����ּ�ˮ���ϣ��������ƫ����Ũ��ƫС����D��ȷ��
�ʴ�Ϊ��CD��

����Ŀ����֪������R2��ԭ�Ӻ�����n�����ӣ�Rԭ�ӵ�������Ϊm����wgR2�����е��ӵ����ʵ����ǣ� ��
A.![]() molB.
molB.![]() molC.
molC.![]() molD.
molD.![]() mol
mol
����Ŀ��ʵ������CH3CH2OH�������Ʊ�1��2-����������������������������Ҵ��Ʊ�1��2-���������װ������ͼ��ʾ��
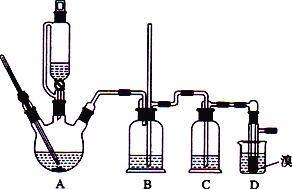
�й������б����£�
�������� | �Ҵ� | 1��2-�������� | ���� |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/(g��cm��3) | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
�ش��������⣺
(1)װ��A�з����Ļ�ѧ����ʽΪ_________________________________����Ӧ����Ϊ________���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170 �����ң�������ҪĿ����________(����ĸ)��
a ������Ӧ�� b���ٸ������������� c ��ֹ�Ҵ��ӷ� d�ӿ췴Ӧ����
(2)��װ��C��Ӧ����________(����ĸ)����Ŀ�������շ�Ӧ�п������ɵ��������塣
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
(3) װ��D��ʵ������Ϊ_______________��
(4)��1��2-��������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��________(����������������)�㡣
(5)��Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ����____________________________��