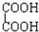题目内容
现有0.175mol/L醋酸钠溶液500mL(已知醋酸的电离常数Ka=1.75×10-5)
(1)写出醋酸钠水解反应的化学方程式 .
(2)下列图象能说明醋酸钠的水解反应达到平衡的是 .

(3)在醋酸钠溶液中加入下列少量物质,水解平衡向正反应方向移动的有 .
A.冰醋酸 B.纯碱固体 C.醋酸钙固体 D.氯化铵固体
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中微粒浓度的关系式能成立的有 .
A.c(CH3COO-)+c(CH3COOH)>c(Na+) B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.c(CH3COO-)>c(H+)>c(OH-)>c(Na+)
(5)欲配制0.175mol/L醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取 g无水醋酸钠,溶于适量水中,配成500mL溶液.
方案二:用体积均为250mL且浓度均为 的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和).
(6)在室温下,0.175mol/L醋酸钠溶液的PH约为 (已知醋酸根的水解反应的平衡常数K=
).
(1)写出醋酸钠水解反应的化学方程式
(2)下列图象能说明醋酸钠的水解反应达到平衡的是

(3)在醋酸钠溶液中加入下列少量物质,水解平衡向正反应方向移动的有
A.冰醋酸 B.纯碱固体 C.醋酸钙固体 D.氯化铵固体
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中微粒浓度的关系式能成立的有
A.c(CH3COO-)+c(CH3COOH)>c(Na+) B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.c(CH3COO-)>c(H+)>c(OH-)>c(Na+)
(5)欲配制0.175mol/L醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取
方案二:用体积均为250mL且浓度均为
(6)在室温下,0.175mol/L醋酸钠溶液的PH约为
| Kw |
| Ka(CH3COOH) |
考点:离子浓度大小的比较,化学平衡状态的判断,弱电解质在水溶液中的电离平衡,溶液的配制
专题:电离平衡与溶液的pH专题
分析:(1)醋酸钠是强碱弱酸盐,醋酸钠水解生成醋酸和氢氧化钠;
(2)醋酸钠溶液中醋酸根离子水解生成醋酸,所以溶液中醋酸根离子浓度逐渐减小直至达到平衡状态,溶液的PH逐渐增大直至不变,水的离子积常数、钠离子数都不变;
(3)增大反应物的浓度或减小生成物浓度,则水解反应向正反应方向移动;
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中存在物料守恒、电荷守恒,据此解答;
(5)根据m=CVM计算溶质的质量;
(6)根据水解平衡常数K=
进行计算.
(2)醋酸钠溶液中醋酸根离子水解生成醋酸,所以溶液中醋酸根离子浓度逐渐减小直至达到平衡状态,溶液的PH逐渐增大直至不变,水的离子积常数、钠离子数都不变;
(3)增大反应物的浓度或减小生成物浓度,则水解反应向正反应方向移动;
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中存在物料守恒、电荷守恒,据此解答;
(5)根据m=CVM计算溶质的质量;
(6)根据水解平衡常数K=
| KW |
| Ka(CH3COOH) |
解答:
解:(1)醋酸钠水解生成醋酸和氢氧化钠,化学方程式为CH3COONa+H2O?CH3COOH+NaOH,故答案为:CH3COONa+H2O?CH3COOH+NaOH;
(2)A.钠离子不水解,所以浓度始终不变,故A错误;
B.醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不再变化,故B正确;
C.随着水解的逐渐进行,pH逐渐增大,平衡时不再变化,故C正确;
D.KW是一温度常数,温度不变,KW不变,故D错误;
故选BC;
(3)A.加入冰醋酸溶液中醋酸浓度增大,平衡左移,故A错误;
B.加入纯碱固体,对平衡体系的离子浓度无影响,平衡不移动,故B错误;
C.加入醋酸钙固体,溶液在醋酸根离子浓度增大,平衡右移,故C正确;
D.加入氯化铵固体,铵根离子与水解生成的氢氧根离子结合成一水合氨,使溶液中氢氧根离子浓度减小,平衡右移,故D正确;
故选CD;
(4)A.加入冰醋酸,使醋酸根离子浓度增大,但钠离子浓度不变,所以存在c(CH3COO-)+c(CH3COOH)>c(Na+),故A正确;
B.加入少量冰醋酸,平衡左移,醋酸根离子浓度增大,大于钠离子浓度,故B错误;
C.加入冰醋酸,当溶液中醋酸浓度较大时,醋酸的电离大于醋酸根离子的水解程度,醋酸根离子浓度增大,溶液呈酸性,故C正确;
D.无论是否电离程度大于水解程度,都不会存在c(OH-)>c(Na+),故D错误;
故选AC.
(5)有m=nM=CVM=0.175mol/L×0.5L×82g/mol=7.175g,所以托盘天平称量的质量为7.2g,
醋酸与氢氧化钠等浓度等体积混合,混合后的溶液浓度减半为0.175mol/L,所以原来的浓度为0.35mol/L,
故答案为:7.2;0.35mol/L;
(6)水解平衡常数K=
=
=
=
,C(OH-)=10-3 mol/L,则溶液的pH=9,故答案为:9.
(2)A.钠离子不水解,所以浓度始终不变,故A错误;
B.醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不再变化,故B正确;
C.随着水解的逐渐进行,pH逐渐增大,平衡时不再变化,故C正确;
D.KW是一温度常数,温度不变,KW不变,故D错误;
故选BC;
(3)A.加入冰醋酸溶液中醋酸浓度增大,平衡左移,故A错误;
B.加入纯碱固体,对平衡体系的离子浓度无影响,平衡不移动,故B错误;
C.加入醋酸钙固体,溶液在醋酸根离子浓度增大,平衡右移,故C正确;
D.加入氯化铵固体,铵根离子与水解生成的氢氧根离子结合成一水合氨,使溶液中氢氧根离子浓度减小,平衡右移,故D正确;
故选CD;
(4)A.加入冰醋酸,使醋酸根离子浓度增大,但钠离子浓度不变,所以存在c(CH3COO-)+c(CH3COOH)>c(Na+),故A正确;
B.加入少量冰醋酸,平衡左移,醋酸根离子浓度增大,大于钠离子浓度,故B错误;
C.加入冰醋酸,当溶液中醋酸浓度较大时,醋酸的电离大于醋酸根离子的水解程度,醋酸根离子浓度增大,溶液呈酸性,故C正确;
D.无论是否电离程度大于水解程度,都不会存在c(OH-)>c(Na+),故D错误;
故选AC.
(5)有m=nM=CVM=0.175mol/L×0.5L×82g/mol=7.175g,所以托盘天平称量的质量为7.2g,
醋酸与氢氧化钠等浓度等体积混合,混合后的溶液浓度减半为0.175mol/L,所以原来的浓度为0.35mol/L,
故答案为:7.2;0.35mol/L;
(6)水解平衡常数K=
| KW |
| Ka(CH3COOH) |
| c(H+).c(OH-) | ||
|
| c2(OH-) |
| c(CH3COO-) |
| 10-14 |
| 1.75×10-5 |
点评:本题考查较综合,涉及水解平衡常数的计算、盐类水解平衡移动方向的判断等知识点,难点是水解平衡常数公式的灵活变换,注意(5)题托盘天平的感量,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
运用元素周期律分析下面的推断,其中错误的是( )
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹化银不溶于水也不溶于稀硝酸 |
| C、硫酸镭是难溶于水的白色固体 |
| D、锗单质是一种优良的半导体材料 |
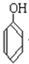
 与
与
 与
与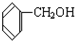
 与
与
 与
与