题目内容
运用元素周期律分析下面的推断,其中错误的是( )
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹化银不溶于水也不溶于稀硝酸 |
| C、硫酸镭是难溶于水的白色固体 |
| D、锗单质是一种优良的半导体材料 |
考点:同一主族内元素性质递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:A.同主族元素的原子,从上到下氢化物的稳定性逐渐减弱;
B.同主族,元素化合物性质相似;
C.同主族,元素化合物性质相似;
D.Ge位于金属元素与非金属元素的交界处.
B.同主族,元素化合物性质相似;
C.同主族,元素化合物性质相似;
D.Ge位于金属元素与非金属元素的交界处.
解答:
解:A.主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以硒化氢(H2Se)不如H2S稳定,故A错误;
B.Cl、At同主族,AgCl不溶于水和硝酸,则砹化银不溶于水也不溶于稀硝酸,故B正确
C.锶与钡是同主族元素,BaSO4是难溶于水的白色固体,所以SrSO4也是难溶于水的白色固体,故C正确;
D.Ge位于金属元素与非金属元素的交界处,则锗单质是一种优良的半导体材料,故D正确;
故选A.
B.Cl、At同主族,AgCl不溶于水和硝酸,则砹化银不溶于水也不溶于稀硝酸,故B正确
C.锶与钡是同主族元素,BaSO4是难溶于水的白色固体,所以SrSO4也是难溶于水的白色固体,故C正确;
D.Ge位于金属元素与非金属元素的交界处,则锗单质是一种优良的半导体材料,故D正确;
故选A.
点评:本题考查同主族元素的性质的相似性和递变性,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握元素周期律的递变性和相似性.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )
| A、点燃,能燃烧的是矿物油 |
| B、测定沸点,有固定沸点的是矿物油 |
| C、加入水中,浮在水面上的是地沟油 |
| D、加入足量氢氧化钠溶液共热,不分层的是地沟油 |
在CH3-CHCl-CH2Cl中被溴取代2个氢原子后,可能有的同分异构体有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列比较,不正确的是( )
| A、酸性:HClO4>H2SO4>H3PO4 |
| B、碱性:KOH>Mg(OH)2>Al(OH)3 |
| C、稳定性:H2S<HCl<HF |
| D、离子半径:S2->Cl->Ca2+>K+ |
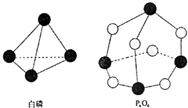 化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ?mol-1)P-P:198 P-O:360 O═O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ?mol-1)P-P:198 P-O:360 O═O:498则反应P4(白磷)+3O2→P4O6的能量变化为( )| A、释放1638kJ的能量 |
| B、吸收1638kJ的能量 |
| C、释放126kJ的能量 |
| D、吸收126kJ的能量 |
下列化学键中,都属于极性共价键的是( )
| A、共价化合物中的化学键 |
| B、离子化合物中的共价键 |
| C、同种元素原子间的共价键 |
| D、不同元素原子间的共价键 |
某有机物的结构简式为 ,等物质的量的该有机化合物分别与 Na、NaOH和新制Cu(OH)2悬浊液充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )
,等物质的量的该有机化合物分别与 Na、NaOH和新制Cu(OH)2悬浊液充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )
 ,等物质的量的该有机化合物分别与 Na、NaOH和新制Cu(OH)2悬浊液充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )
,等物质的量的该有机化合物分别与 Na、NaOH和新制Cu(OH)2悬浊液充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )| A、6:4:5 |
| B、1:1:1 |
| C、3:2:2 |
| D、3:2:3 |
