题目内容
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
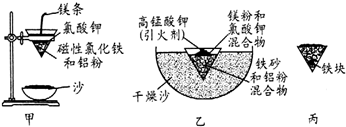
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 .
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 .
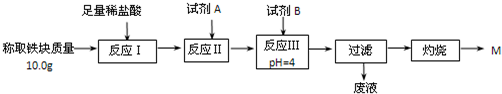
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择 ,试剂B应选择 .(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol?L-1.
③灼烧完全的标志是 .
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是 .如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 .

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是
(2)若证明上述所得“铁块”中含有金属铝,可选择
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=
③灼烧完全的标志是
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是
考点:探究铝热反应
专题:实验设计题
分析:(1)考虑生成的熔融的铁的还原性,可以被空气中的氧气氧化导致生成三价的铁;
(2)根据铝与铁的性质的差异性来选择试剂,并写出反应;
(3)①根据题意可知,本实验要定量检测所得“铁块”的成分,故要通过实验流程,将铁元素完全沉淀;而根据表格可知,要使铁元素完全沉淀而铝和镁不沉淀,需将Fe2+转化为Fe3+,然后沉淀.
②根据Fe(OH)3的Ksp的表达式来进行计算;
③灼烧完全的标志是物质前后两次灼烧质量相差不大于0.1g;
④根据10.0g的铁块中的铁元素最终全到了最终红色粉未M中,根据铁原子的守恒来计算;如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,此时应考虑Fe(OH)3的分解,引起计算结果偏小.
(2)根据铝与铁的性质的差异性来选择试剂,并写出反应;
(3)①根据题意可知,本实验要定量检测所得“铁块”的成分,故要通过实验流程,将铁元素完全沉淀;而根据表格可知,要使铁元素完全沉淀而铝和镁不沉淀,需将Fe2+转化为Fe3+,然后沉淀.
②根据Fe(OH)3的Ksp的表达式来进行计算;
③灼烧完全的标志是物质前后两次灼烧质量相差不大于0.1g;
④根据10.0g的铁块中的铁元素最终全到了最终红色粉未M中,根据铁原子的守恒来计算;如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,此时应考虑Fe(OH)3的分解,引起计算结果偏小.
解答:
解:(1)铝热反应生成的熔融的铁具有很强的还原性,可以被空气中的氧气氧化导致生成三价的铁,故答案为:熔融的铁被空气中氧气氧化;
(2)要证明“铁块”中含有金属铝,应利用铁和铝性质的差异性,即铁不能和碱反应,而铝可以,故应选择氢氧化钠溶液,与铝反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:氢氧化钠溶液 2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)①根据表格可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,调节pH选用的试剂不能用氧化铁,因为会引起红色粉未M的质量偏大;也不能用MgCO3固体,因为MgCO3固体过量时会引起所得固体M则质量偏大,故应选用氨水,故选:C D
②根据Fe(OH)3的Ksp=C(Fe3+)?C3(OH-)=1.1×10-36,而pH=4,故C(OH-)=10-10mol/L,带入Ksp=C(Fe3+)?C3(OH-)=1.1×10-36,计算得C(Fe3+)=1.1×10-6mol/L,故答案为:1.1×10-6
③灼烧完全的标志是物质前后两次灼烧质量相差不大于0.1g,故答案为:前后两次灼烧质量相差不大于0.1g
④最终红色粉未M为Fe2O3,根据10.0g的铁块中的铁元素最终全到了12.0gFe2O3中,故铁原子的质量为:m(Fe)=
×2×56gmol=8.4g
故该“铁块”的纯度=
×100%=84%;如果对所得过滤固体直接洗涤、烘干、称量,烘干过程中会引起Fe(OH)3的分解,故会导致计算结果偏小.
故答案为:84% 偏小 Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
(2)要证明“铁块”中含有金属铝,应利用铁和铝性质的差异性,即铁不能和碱反应,而铝可以,故应选择氢氧化钠溶液,与铝反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:氢氧化钠溶液 2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)①根据表格可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,调节pH选用的试剂不能用氧化铁,因为会引起红色粉未M的质量偏大;也不能用MgCO3固体,因为MgCO3固体过量时会引起所得固体M则质量偏大,故应选用氨水,故选:C D
②根据Fe(OH)3的Ksp=C(Fe3+)?C3(OH-)=1.1×10-36,而pH=4,故C(OH-)=10-10mol/L,带入Ksp=C(Fe3+)?C3(OH-)=1.1×10-36,计算得C(Fe3+)=1.1×10-6mol/L,故答案为:1.1×10-6
③灼烧完全的标志是物质前后两次灼烧质量相差不大于0.1g,故答案为:前后两次灼烧质量相差不大于0.1g
④最终红色粉未M为Fe2O3,根据10.0g的铁块中的铁元素最终全到了12.0gFe2O3中,故铁原子的质量为:m(Fe)=
| 12.0g |
| 160g/mol |
故该“铁块”的纯度=
| 8.4g |
| 10.0g |
故答案为:84% 偏小 Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
点评:本题综合考查了铝热反应以及亚铁离子向三价铁离子的转化以及离子的沉淀,综合性较强,难度较大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列比较,不正确的是( )
| A、酸性:HClO4>H2SO4>H3PO4 |
| B、碱性:KOH>Mg(OH)2>Al(OH)3 |
| C、稳定性:H2S<HCl<HF |
| D、离子半径:S2->Cl->Ca2+>K+ |
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.

 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示: