题目内容
雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.
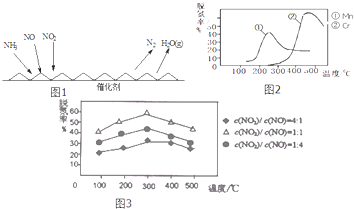
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由图1可知SCR技术中的氧化剂为: .
②图2是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图可知最佳的催化剂和相应的温度分别为: 、 .
③用Fe做催化剂时,在氨气足量的情况下,不同
对应的脱氢率如图3所示,脱氢效果最佳的
= .已知生成1mol N2反应放出的热量为Q kJ,此时对应的脱氢反应的热化学方程式为 .
(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l)?H2SO3(l)?H+(aq)+HSO3-(aq) I
HSO3-(aq)?H+(aq)+SO32-(aq)Ⅱ
Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)Ⅲ
Ca2+(aq)+SO32-(aq)?CaSO3(s)Ⅳ
④步骤Ⅱ的平衡常数K的表达式为
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度.(写出计算过程,保留2位有效数字)

(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由图1可知SCR技术中的氧化剂为:
②图2是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图可知最佳的催化剂和相应的温度分别为:
③用Fe做催化剂时,在氨气足量的情况下,不同
| c(NO2) |
| c(NO) |
| c(NO2) |
| c(NO) |
(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l)?H2SO3(l)?H+(aq)+HSO3-(aq) I
HSO3-(aq)?H+(aq)+SO32-(aq)Ⅱ
Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)Ⅲ
Ca2+(aq)+SO32-(aq)?CaSO3(s)Ⅳ
④步骤Ⅱ的平衡常数K的表达式为
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度.(写出计算过程,保留2位有效数字)
考点:化学平衡常数的含义,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:(1)①得电子化合价降低的反应物是氧化剂;
②温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氢即可;
③根据纵坐标判断,相同温度下,脱氢率越高的效果越好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量;
(2)④平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
⑤利用溶度积常数计算溶液中亚硫酸根离子浓度.
②温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氢即可;
③根据纵坐标判断,相同温度下,脱氢率越高的效果越好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量;
(2)④平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
⑤利用溶度积常数计算溶液中亚硫酸根离子浓度.
解答:
解:(1)①根据图象知,反应物是NO、NO2和NH3,生成物是N2和H2O,氮氧化物中N元素化合价由正化合价变为0价、氨气中N元素化合价由-3价变为0价,所以氧化剂是NO、NO2,故答案为:NO、NO2;
②根据图象知,脱氢率越高越好,但Cr作催化剂时温度高于Mn,温度越高,对设备要求越高,增大生产成本,且脱氢率增大较小,所以使用Mn作催化剂较好;根据图象知,在温度为200-250℃或范围内间任意温度,脱氢率较高,故答案为:Mn;200-250℃或范围内间任意温度;
③根据纵坐标判断,相同温度下,脱氢率越高的效果越好,所以其比值为1:1时最好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol,
故答案为:1:1;2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol;
(2)④平衡常数K=
,
故答案为:
;
⑤C(SO32- )=
=
mol/L=2.0×10-7 mol/L,
故答案为:2.0×10-7 mol/L.
②根据图象知,脱氢率越高越好,但Cr作催化剂时温度高于Mn,温度越高,对设备要求越高,增大生产成本,且脱氢率增大较小,所以使用Mn作催化剂较好;根据图象知,在温度为200-250℃或范围内间任意温度,脱氢率较高,故答案为:Mn;200-250℃或范围内间任意温度;
③根据纵坐标判断,相同温度下,脱氢率越高的效果越好,所以其比值为1:1时最好;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol,
故答案为:1:1;2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol;
(2)④平衡常数K=
| c(H+).c(SO32-) |
| c(HSO3-) |
故答案为:
| c(H+).c(SO32-) |
| c(HSO3-) |
⑤C(SO32- )=
| Ksp(CaSO3) |
| c(Ca2+) |
| 1.4×10-7 |
| 0.70 |
故答案为:2.0×10-7 mol/L.
点评:本题考查较综合,涉及图象分析、难溶物的溶解平衡、平衡常数的含义等知识点,利用溶度积常数、平衡常数等知识点进行计算,注意图象分析中的曲线的变化趋势,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列化学键中,都属于极性共价键的是( )
| A、共价化合物中的化学键 |
| B、离子化合物中的共价键 |
| C、同种元素原子间的共价键 |
| D、不同元素原子间的共价键 |
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.

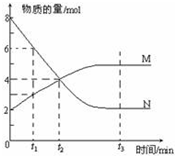 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示: 的烃可命名为
的烃可命名为