题目内容
Ⅰ.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H
(1)已知:①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0KJ?mol-1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5KJ?mol-1;则△H= kJ?mol-1.
(2)高炉炼铁反应的平衡常数,温度升高后,K值 (填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为 .
②下列说法正确的是 (填字母).
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2
D.增加Fe2O3的量可以提高CO的转化率
Ⅱ.(1)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为 .
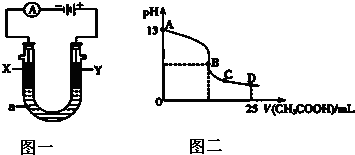
(2)以上述电池为电源,通过导线连接成图一电解池.
①若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 .
②若X、Y分别为铜、银,a为1L 0.2mol/L AgNO3溶液,写出Y电极反应式 .
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图二计算,上述电解过程中消耗一氧化碳的质量为 g.
②若图二的B点pH=7,则滴定终点在 区间(填“AB”、“BC”或“CD”).
(1)已知:①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0KJ?mol-1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5KJ?mol-1;则△H=
(2)高炉炼铁反应的平衡常数,温度升高后,K值
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是
A.当容器内气体密度恒定,表明反应达到平衡状态
B.甲容器中CO的平衡时的速率小于乙容器中CO平衡时的速率
C.甲、乙容器中,CO的平衡浓度之比为3:2
D.增加Fe2O3的量可以提高CO的转化率
Ⅱ.(1)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为

(2)以上述电池为电源,通过导线连接成图一电解池.
①若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式
②若X、Y分别为铜、银,a为1L 0.2mol/L AgNO3溶液,写出Y电极反应式
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图二计算,上述电解过程中消耗一氧化碳的质量为
②若图二的B点pH=7,则滴定终点在
考点:化学平衡的计算,热化学方程式,原电池和电解池的工作原理
专题:化学平衡专题,电化学专题
分析:Ⅰ?(1)依据热化学方程式和盖斯定律计算分析判断;
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,反应是吸热反应,升温平衡逆向进行;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
B.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,速率甲小于乙;
C.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率;
Ⅱ?(1)CO发生氧化反应与O2-结合生成CO32-;
(2)①阳极上氯离子失电子,阴极上阳离子得电子;
②Y为阳极,阳极上银失电子生成银离子;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据KOH和转移电子正极的关系式计算转移电子,再根据转移电子守恒计算CO的质量;
②滴定终点二者恰好反应生成CH3COOK.
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,反应是吸热反应,升温平衡逆向进行;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
B.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,速率甲小于乙;
C.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率;
Ⅱ?(1)CO发生氧化反应与O2-结合生成CO32-;
(2)①阳极上氯离子失电子,阴极上阳离子得电子;
②Y为阳极,阳极上银失电子生成银离子;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据KOH和转移电子正极的关系式计算转移电子,再根据转移电子守恒计算CO的质量;
②滴定终点二者恰好反应生成CH3COOK.
解答:
解:Ⅰ?(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,
故答案为:-28.5;
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,反应是放热反应,升温平衡逆向进行,平衡常数减小,
故答案为:减小;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=
=
=64,计算得到x=0.6
转化率=60%,
故答案为:60%;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故A正确;
B.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,乙容器中压强大于甲,反应速率乙大,故B正确;
C.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;故C错误;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故D错误;
故答案为:AB.
Ⅱ?(1)负极CO发生氧化反应与O2-结合生成CO32-,负极电极反应式为:CO+2O2--2e-=CO32-,
故答案为:CO+2O2--2e-=CO32-;
(2)①阳极上氯离子失电子,阴极上阳离子得电子,所以电解0.1mol/L KCl溶液,其电解总反应的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
②Y为阳极,阳极上银失电子生成银离子,其电极反应为:Ag-e=Ag+;
故答案为:Ag-e=Ag+;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O
2OH-+H2↑+Cl2↑知,生成0.2mol氢氧根离子转移电子的物质的量=
×2=0.2mol,燃料电池的负极反应方程式是CO+2O2--2e-=CO32-,消耗1molCO转移电子数=2mol,因此当转移0.2mol电子时消耗CO的物质的量为0.1mol,则CO的质量=0.1mol×28g/mol=2.8g,
故答案为:2.8;
②滴定终点二者恰好反应生成CH3COOK,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的pH=7时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB.
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,
故答案为:-28.5;
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,反应是放热反应,升温平衡逆向进行,平衡常数减小,
故答案为:减小;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=
| c3(CO2) |
| c3(CO) |
| (1+x)3 |
| (1-x)3 |
转化率=60%,
故答案为:60%;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故A正确;
B.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,乙容器中压强大于甲,反应速率乙大,故B正确;
C.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;故C错误;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故D错误;
故答案为:AB.
Ⅱ?(1)负极CO发生氧化反应与O2-结合生成CO32-,负极电极反应式为:CO+2O2--2e-=CO32-,
故答案为:CO+2O2--2e-=CO32-;
(2)①阳极上氯离子失电子,阴极上阳离子得电子,所以电解0.1mol/L KCl溶液,其电解总反应的离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
②Y为阳极,阳极上银失电子生成银离子,其电极反应为:Ag-e=Ag+;
故答案为:Ag-e=Ag+;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O
| ||
| 0.2mol |
| 2 |
故答案为:2.8;
②滴定终点二者恰好反应生成CH3COOK,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的pH=7时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB.
点评:本题考查了热化学方程式和盖斯定律计算应用、平衡常数计算应用、化学平衡三段式列式计算方法、原电池和电解池原理、离子浓度大小的判断、根据电极上得失电子判断原电池正负极、根据离子放电顺序确定电解池中电池反应式,难点是图2中各点溶质的判断,难度较大.

练习册系列答案
相关题目
在CH3-CHCl-CH2Cl中被溴取代2个氢原子后,可能有的同分异构体有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
某有机物的结构简式为 ,等物质的量的该有机化合物分别与 Na、NaOH和新制Cu(OH)2悬浊液充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )
,等物质的量的该有机化合物分别与 Na、NaOH和新制Cu(OH)2悬浊液充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )
 ,等物质的量的该有机化合物分别与 Na、NaOH和新制Cu(OH)2悬浊液充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )
,等物质的量的该有机化合物分别与 Na、NaOH和新制Cu(OH)2悬浊液充分反应(反应时可加热煮沸),所需Na、NaOH和Cu(OH)2的物质的量之比为( )| A、6:4:5 |
| B、1:1:1 |
| C、3:2:2 |
| D、3:2:3 |
同周期的X、Y、Z三种元素,已知最高价氧化物的水化物酸性由强到弱顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
| A、原子序数:X>Y>Z |
| B、非金属性:X>Y>Z |
| C、原子半径:X>Y>Z |
| D、气态氢化物的稳定性:HX>H2Y>ZH3 |
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
