题目内容
(15分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
当A中压力过大时,安全管中液面上升,使A瓶中压力稳定
碱 酚酞(或甲基红)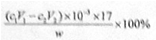
偏低
防止硝酸银见光分解 2.8×10—3
+3 2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
解析试题分析:(1)分析题给装置知,装置中安全管的作用原理是当A中压力过大时,安全管中液面上升,使A瓶中压力稳定。(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞(或甲基红)。(3)根据题给信息知,氨的测定过程中发生反应HCl+NH3 NH4Cl,则样品中氨的物质的量与和氨气反应的HCl的物质的量相等,为(c1V1—c2V2)×10—3mol,则氨气的质量为
NH4Cl,则样品中氨的物质的量与和氨气反应的HCl的物质的量相等,为(c1V1—c2V2)×10—3mol,则氨气的质量为
(c1V1—c2V2)×10—3×17g,质量分数表达式为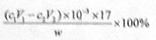 。(4)测定氨前应该对装置进行气密性检验,若气密性不好会导致氨气逸出,测定结果将偏低。(5)测定氯的过程中,用硝酸银溶液滴定,硝酸银见光易分解,故使用棕色滴定管的原因是防止硝酸银见光分解;根据沉淀溶解平衡知识知,c(CrO42—) =Ksp(Ag2CrO4)/ c2(Ag+)= 1.12×10—12/(2.0×10—5)2=2.8×10—3mol·L—1。(6)根据题意知,样品X中钴、氨、氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,利用化合价规则判断,钴的化合价为+3;根据题给信息知,CoCl2·6H2O、NH4Cl、H2O2、浓氨水在活性炭催化下,合成橙黄色晶体X,化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2
。(4)测定氨前应该对装置进行气密性检验,若气密性不好会导致氨气逸出,测定结果将偏低。(5)测定氯的过程中,用硝酸银溶液滴定,硝酸银见光易分解,故使用棕色滴定管的原因是防止硝酸银见光分解;根据沉淀溶解平衡知识知,c(CrO42—) =Ksp(Ag2CrO4)/ c2(Ag+)= 1.12×10—12/(2.0×10—5)2=2.8×10—3mol·L—1。(6)根据题意知,样品X中钴、氨、氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,利用化合价规则判断,钴的化合价为+3;根据题给信息知,CoCl2·6H2O、NH4Cl、H2O2、浓氨水在活性炭催化下,合成橙黄色晶体X,化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O;X的制备过程中温度不能过高的原因是温度过高过氧化氢分解、氨气逸出。
2[Co(NH3)6]Cl3+2H2O;X的制备过程中温度不能过高的原因是温度过高过氧化氢分解、氨气逸出。
考点:考查物质组成的实验测定,涉及化学实验基本操作、化学方程式的书写、实验方案分析及相关计算。

测定Cu(NO3)2?nH2O的结晶水含量,下列方案中不可行的是( )
| A.称量样品→加热→冷却→称量CuO |
| B.称量样品→加热→冷却→称量Cu(NO3)2 |
| C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
| D.称量样品→加NaOH→过滤→加热→冷却→称量CuO |
(15分)某研究小组设计如下装置分离CO和CO2的混合气体并探究CO还原氧化铜的产物和过氧化钠的性质。已知氯化钯(PdCl2)溶液遇CO气体会产生黑色沉淀(金属单质)。夹持装置未画出。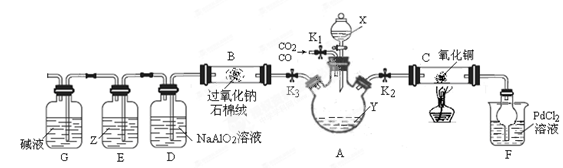
(题9图)
(1)试剂X、Y的焰色反应均呈黄色,则X、Y可能是 、 .
(2)连接装置、检验气密性并装好药品后,关闭分液漏斗活塞和K3,打开K1、K2,分离出CO,当观察到 现象时,可对C装置进行加热操作,反应产物为红色固体。
(3)查询资料获得以下信息:①Cu2O为红色固体;②常温下,Cu2+在溶液中稳定,Cu+易在酸性条件下发生反应:2Cu+ =Cu2++Cu。
甲、乙两组同学取上述红色固体(用M代表)进行实验,探究其成分:
| 组别 | 实验操作 | 实验现象或数据 | 结 论 |
| 甲 | ① 向a g M中加入一定量稀硫酸,充分搅拌; ② 继续滴加稀硫酸至过量, 充分反应. | ①固体明显减少; ②仍然有一定量固体,溶液呈蓝色 | ①M中一定有Cu2O; ②M中一定有Cu. |
| 乙 | 将甲实验后所得溶液过滤 将滤渣洗涤、干燥、称量 | 滤渣质量为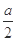 g g | M为Cu和Cu2O的混合物 |
(ii)甲组同学配合乙组同学进行了计算,认为乙组同学的结论是正确的,并得出M中Cu和Cu2O的物质的量之比是 .
(4)C装置反应结束后,欲从混合气体中分离出CO2,需进行的主要操作是 .实验过程中D装置产生白色沉淀的离子方程式为 .
(5)Z试剂为混有KI的苯溶液,则E装置中可能产生的现象是 .
(12分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请你帮助该同学整理并完成实验报告:
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成小球,在水面上游动,随之消失,溶液变红 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变为浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可在空气中燃烧 |
| ④镁带与2mol/L盐酸反应 | (D)剧烈反应,产生可燃气体 |
| ⑤铝条与2mol/L盐酸反应 | (E)生成白色胶状沉淀,后来沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |
(2) 实验用品:
仪器: ①________②________③________④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸等;
药品:钠、镁带、铝条、2mol/L的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等。
(3) 实验内容:(填写与实验方案相对应的实验现象)
①______②______③______④______⑤______⑥______(用A-F表示)
(4) 实验结论:
金属性: ________________ 非金属性: ________________
(5)写出⑥的总反应离子方程式:_________________________________。
(15分)乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
乙酰苯胺的制备原理为: 
实验参数:
| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体, 具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:
步聚1:在100ml圆底烧瓶中加入无水苯胺9.1mL,冰醋酸17.4mL,锌粉0.1g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,

调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步聚2: 在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步聚3: 将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼。产品放在干净的表面皿中晾干,称重,计算产率。
请回答下列问题:
(1)实验中加入锌粉的目的是
(2)为何要控制分馏柱上端的温度在105?C左右
(3)通过什么现象可判断反应基本完成
(4)步聚1加热可用 (填“水浴”或“油浴”),步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是 。
(5)洗涤乙酰苯胺粗品最合适的试剂是 。
A. 用少量冷水洗 B. 用少量热水洗
C. 先用冷水洗,再用热水洗 D. 用酒精洗
(6)该实验最终得到纯品8.1克,则乙酰苯胺的产率是 。




