题目内容
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式____________________________________________________。
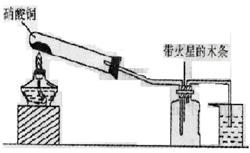
(2)实验装置(如图所示)
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为y g,滴定管的读数为a mL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞_____________,打开活塞______________,通过分液漏斗加入稀硫酸,与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞_____________,打开活塞_____________,通过分液漏斗加入过量____________(填化学式),与烧瓶内物质充分反应。
④__________________(填入该步应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为z g,
(4)数据分析
①AlN的质量分数为___________________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________________(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为________。(该实验条件下的气体摩尔体积为Vm)。
(1)AlN+NaOH+H2O=NaAlO2+NH3↑
(3)②K2、K3 K1
③K1 K3 NaOH
④打开K2, 通入空气一段时间
(4)①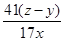 ×100% ②偏小 ③
×100% ②偏小 ③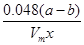 ×100%
×100%
解析

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下述实验能达到预期目的的是
| A.甲图:验证铜与稀硝酸反应的气体产物只有NO |
| B.乙图:实验室制取乙酸乙酯 |
| C.丙图:验证钢铁片发生吸氧腐蚀 |
| D.丁图:证明在相同温度下Mg(OH)2的溶解度大于Fe(OH)3 |
下列实验方案不能达到实验目的的是
| | 实验目的 | 实验方案 |
| A | 研究催化剂对过氧化氢分解速率的影响 | 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一只试管中加入少量MnO2 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mol/LNaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 可以鉴别这两种溶液 | 将Na2CO3溶液与HCl溶液相互滴加 |
| D | 测定铝箔中氧化铝的含量 | 取a g铝箔与足量稀盐酸充分反应,将逸出的气体通过碱石灰后,测其体积为bL(标准状况下) |
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下: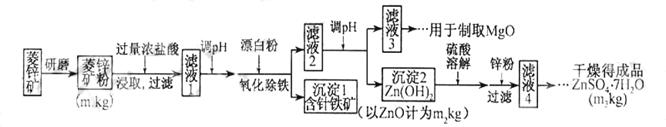
(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
| | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH[来源 | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×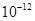 | — | 6.8×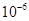 | 2.8×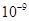 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉b.石灰乳c.纯碱溶液d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
下列有关判断中不正确的是 ( )。
| A.溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B.若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| C.方案一可能产生氢气,方案二可能剩余铜 |
| D.实验室中方案Ⅱ更便于实施 |

 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。