题目内容
某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为__(填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更 (填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为____________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”)。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→____→____→____→____→____→____→h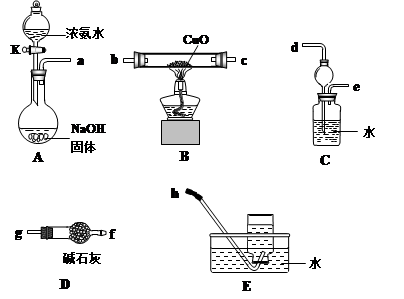
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为______________________。
③装置C中的球形装置的作用是_________________。
(13分,除标明1分外,其余每空均为2分。)(1)bc(对一个给1分,错一个倒扣1分)
(2)①稳定(1分);②Cu2O+2H+=Cu2++Cu+H2O,不稳定(1分) (3)g→f→b→c→d→e
①没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔)
②3CuO+2NH3 3Cu +N2+3H2O(没有条件扣1分) ③防倒吸(1分)
3Cu +N2+3H2O(没有条件扣1分) ③防倒吸(1分)
解析试题分析:(1)证明Al(OH)3呈两性的试剂是强酸和强碱,因此要想证明Cu(OH)2呈两性,也必须选强酸和强碱溶液.硫酸是强酸,所以可以选取;氢氧化钠是强碱,所以可选取;氨水是弱碱,醋酸是弱酸,均不能选择,答案选bc。
(2)①物质都有由不稳定状态转化为稳定状态的倾向,所以根据CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末可知,在高温条件下,+l价的Cu比+2价Cu更稳定。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,这说明氧化亚铜和稀硫酸反应生成的是硫酸铜、水和单质铜,因此该反应的离子化学方程式为Cu2O+2H+=Cu2++Cu+H2O,这说明在酸性溶液中,+1价Cu比+2价Cu更不稳定。
(3)A装置是制备氨气的,生成的氨气中含有水蒸气,需要通过碱石灰干燥。又因为氨气极易溶于水,过量的氨气在进行尾气处理时需要防止倒吸,所以正确的连接顺序是a→g→f→b→c→d→e→h。
①由于反应中由氨气生成,烧瓶内压强大,导致氨水不能滴下,即可能的原因是没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔)。
②实验结束后,装置B中固体由黑色变为红色,这说明有导致铜生成。装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,因此钙气体应该是氮气,所以B装置中发生的化学方程式为3CuO+2NH3 3Cu +N2+3H2O。
3Cu +N2+3H2O。
③由于氨气极易溶于水,直接通入水中吸收,容易倒吸,所以装置C中的球形装置的作用是防倒吸。
考点:考查两性氢氧化物、物质稳定性的判断;装置连接顺序、尾气处理以及有关方程式的书写等

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案实验室需要纯净的NaCl溶液,但实验室的NaCl晶体混有少量Na2SO4和NH4HCO3,某同学按如下流程图设计实验除去杂质,回答下列问题: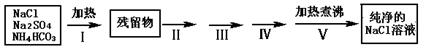
(1)步骤I除去的杂质是(填化学式)_______________,直接加热要好于加强碱后再进行加热,理由是 ;
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
| 操作步骤 | 实验现象 | 实验目的 |
| 步骤II:将残留物溶解得到溶液, | | |
| 步骤III: |  | |
| 步骤IV:过滤,往滤液中 | | |
| 步骤V:将溶液加热煮沸 |  | |
(3)若最后得到20℃的NaCl饱和溶液。已知20℃时NaCl的溶解度为36.0g、NaCl饱和溶液的密度为1.12g/cm3 ,则20℃的NaCl饱和溶液的物质的量浓度为 mol/L(计算结果保留三位有效数字)。
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3?3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是______________________;
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成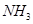 ,写出反应的离子方程式____________________________;
,写出反应的离子方程式____________________________;
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用离子方程式和简要文字表述):
__________________________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol?Lˉ1NaOH溶液、8.0 mol?Lˉ1NaOH溶液、澄清石灰水、0.01 mol?Lˉ1KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是_____; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | |
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理论述中正确的是( )
| A.镁粉只直接与溴水中的溴反应 |
| B.镁粉只与溴水中的酸反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到 |
| D.镁粉在水的催化下与溴发生反应 |
化学与生活是紧密相联的,下列关于生活与化学的说法不正确的是
| A.从海水提取物质不一定都必须通过化学反应才能实现 |
| B.大量的氮、磷废水排入海洋,易引发赤潮 |
| C.为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 |
| D.保护加酶洗衣粉的洗涤效果,应用温水溶解洗衣粉 |