题目内容
13.下列事实能够证明Al2O3中一定存在离子键的是( )| A. | 水溶液能导电 | B. | 有较高的熔点 | C. | 熔化时能导电 | D. | 易溶于水 |
分析 含有离子键的化合物在熔融状态下能导电,只含共价键的化合物在熔融状态下不导电,要证明氧化铝中一定存在离子键,只要熔融状态氧化铝能导电即可,据此分析解答.
解答 解:A.氧化铝不溶于水,其水溶液不导电,故A错误;
B.熔沸点的高低与离子键无关,如金刚石中只含共价键,但熔沸点较高,故B错误;
C.氧化铝熔融状态下能导电,说明熔融状态下电离出自由移动的阴阳离子,所以含有离子键,故C正确;
D.氧化铝不溶于水,且不能根据是否易溶于水判断离子键,故D错误;
故选C.
点评 本题考查离子化合物和共价化合物的判断,侧重考查基本概念,明确物质构成微粒是解本题关键,注意不能根据溶解性大小、熔沸点高低判断离子键,为易错题.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
3.某元素原子的最外层上的电子数是次外层上的电子数的a倍(a>1),则该元素原子核内的质子数为( )
| A. | 2a | B. | 2a+2 | C. | 2a+10 | D. | a+2 |
4.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| B. | 石油干馏可得到石油气、汽油、煤油、柴油等 | |
| C. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| D. | 制作快餐盒的聚苯乙烯塑料是易降解塑料 |
18.有一种MCFC型氢氧燃料电池,电解质为熔融的K2CO3.电池的总反应为:2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2.下列说法中正确的( )
| A. | 正极反应为4OH--4e-=2H2O+O2↑ | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池放电时,电池中CO32-的物质的量将逐渐减少 | |
| D. | 电路中电子由负极、经熔融的K2CO3流到正极,形成闭合回路 |
5.如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
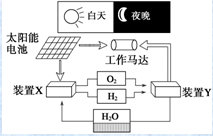

| A. | 装置X能实现燃料电池的燃料和氧化剂再生 | |
| B. | 装置Y中负极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该系统中只存在3种形式的能量转化 | |
| D. | 装置X、Y形成的子系统能实现物质零排放,并能实现化学能与电能间的完全转化 |
2.一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24L(标准状况下),则下列情况不可能的是( )
| A. | 加入Cu的质量为6.4g | B. | 加入Cu的质量大于6.4g | ||
| C. | 加入浓H2SO4中含溶质为0.2mol | D. | 加入浓H2SO4中含溶质大于0.2mol |
3.下列说法正确的是( )
| A. | 同周期ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第3周期元素的离子半径从左到右逐渐减小 |
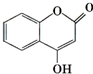 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: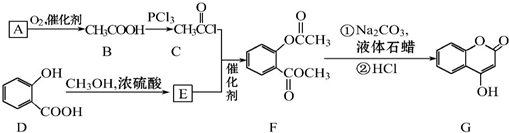
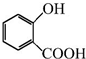 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$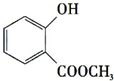 +H2O.
+H2O. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.