题目内容
8. A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.(1)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是2Fe2++Cl2=2Fe3++2Cl-.
(2)若B、C、F都是气态单质,且B有毒,③的反应中还有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是
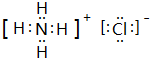 ,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.(3)若A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C、E、F为气体,C有毒,则反应①的化学方程式是2C+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑.列举物质B的一个重要用途光导纤维.
分析 (1)A是生活中常见的金属单质,D、F是气态单质,反应①为置换反应,且在水溶液中进行,由转化关系可知,A为变价金属,F具有强氧化性,可推知A为Fe,F为Cl2,故B为HCl、C为氯化亚铁、D为氢气、E为氯化铁;
(2)B、C、F都是气态单质,B有毒,则B为氯气,反应②需要放电条件才能发生,为氮气与氧气反应,③反应中都有水生成,可以推知C为N2,F为O2,E为NO,A为NH3,反应①为置换反应,A、D相遇有白烟生成,可推知D为HCl;
(3)A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C、E、F为气体,C有毒,反应①为置换反应,考虑是碳与二氧化硅反应生成硅与CO,碳与F反应生成E,CO与F生成E,则F为氧气,验证符合转化关系.
解答 解:(1)A是生活中常见的金属单质,D、F是气态单质,反应①为置换反应,且在水溶液中进行,由转化关系可知,A为变价金属,F具有强氧化性,可推知A为Fe,F为Cl2,故B为HCl、C为氯化亚铁、D为氢气、E为氯化铁,则反应②(在水溶液中进行)的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)B、C、F都是气态单质,B有毒,则B为氯气,反应②需要放电条件才能发生,为氮气与氧气反应,③反应中都有水生成,可知C为N2,F为O2,E为NO,A为NH3,反应①为置换反应,A、D相遇有白烟生成,可推知D为HCl,D反应产物为氯化铵,电子式是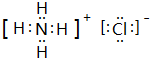 ,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为: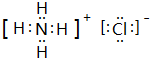 ;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C、E、F为气体,C有毒,反应①为置换反应,考虑是碳与二氧化硅反应生成硅与CO,碳与F反应生成E,CO与F生成E,则F为氧气,反应①的化学方程式是2C+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑,B为二氧化硅,可用于光导纤维,
故答案为:2C+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑;光导纤维.
点评 本题考查无机物的推断,题目信息量大,难度较大,答题时注意根据常见元素化合物的性质和用途考虑,需要学生熟练掌握基础知识.

 阅读快车系列答案
阅读快车系列答案| A. | N2是还原产物,CO2是氧化产物 | |
| B. | 每生成22.4LCO2需转移3 mol电子 | |
| C. | 反应中氧化剂和还原剂的物质的量之比为4:3 | |
| D. | N元素既被氧化,也被还原 |
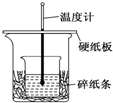 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )| A. | 如图条件下实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高 |
| A. | 石油的分馏 | B. | 煤的干馏 | C. | 石油的裂化 | D. | 煤的气化 |
| A. | 2a | B. | 2a+2 | C. | 2a+10 | D. | a+2 |
| A. | Fe2(SO4)3和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2 SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
| A. | 正极反应为4OH--4e-=2H2O+O2↑ | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池放电时,电池中CO32-的物质的量将逐渐减少 | |
| D. | 电路中电子由负极、经熔融的K2CO3流到正极,形成闭合回路 |
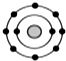
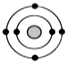
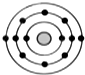
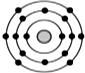
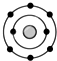 某元素原子的核外电子排布示意图如图所示,下列原子中,与该元素原子的化学性质相似的是( )
某元素原子的核外电子排布示意图如图所示,下列原子中,与该元素原子的化学性质相似的是( )