题目内容
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
【答案】D
【解析】
将X为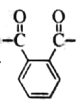 Y为
Y为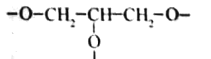 带入到交联聚合物P的结构中可知,聚合物P是由邻苯二甲酸和丙三醇通过缩聚反应制备的,据此解题;
带入到交联聚合物P的结构中可知,聚合物P是由邻苯二甲酸和丙三醇通过缩聚反应制备的,据此解题;
A.根据X为 Y为
Y为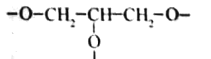 可知,X与Y直接相连即羰基与醚键直接相连构成了酯基,酯基能在酸性或碱性条件下水解,故A不符合题意;
可知,X与Y直接相连即羰基与醚键直接相连构成了酯基,酯基能在酸性或碱性条件下水解,故A不符合题意;
B.聚合物P是由邻苯二甲酸和丙三醇通过缩聚反应制备的,故B不符合题意;
C.油脂为脂肪酸甘油酯,其在碱性条件下水解可生成脂肪酸盐和甘油即丙三醇,故C,不符合题意;
D.乙二醇的结构简式为HO-CH2CH2-OH,与邻苯二甲酸在聚合过程中只能形成链状结构,故D符合题意;
综上所述,本题应选D。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
I.NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
(1)写出NO2和SO2反应的热化学方程式为_________.
(2)随温度升高,该反应化学平衡常数变化趋势是_____.
II.(1)目前,应用NH3的催化还原法来进行烟气氮氧化物脱除,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0,该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
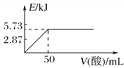
(2)已知4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
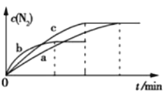
①与容器a中的反应相比,容器b中的反应改变的实验条件可能是_______,判断的依据是___________________。
②一定温度下,下列能说明反应已达到平衡状态的是____
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(3)用NH3和Cl2反应可以制备具有强氧化性的三氯胺(三氯胺在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质),方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②该反应的ΔH__________0(填“>”或“<”)。
③该反应自发进行的条件是__________(填高温、低温、任何温度)。
④对该反应,下列说法正确的是_________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动
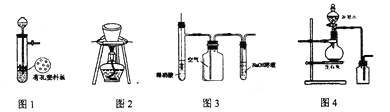
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示![]() 省略夹持和净化装置
省略夹持和净化装置![]() 仅用此装置和表中提供的物质完成相关实验,最合理的选项是
仅用此装置和表中提供的物质完成相关实验,最合理的选项是
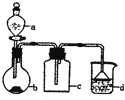
选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 |
A | 浓氨水 | NaOH |
|
|
B | 浓盐酸 |
|
| NaOH溶液 |
C | 稀硝酸 | Cu | NO |
|
D | 浓硫酸 |
|
| NaOH溶液 |
A.AB.BC.CD.D