题目内容
10.下列方程式中是某种盐的水解方程式的是( )| A. | HCO3-+H2O?CO32-+H3O+ | B. | H2O+H2O?H3O++OH- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
分析 弱酸根离子或弱碱离子结合水电离的氢离子或氢氧根离子生成弱电解质和氢氧根离子或氢离子的反应,为水解反应,以此来解答.
解答 解:A.HCO3-+H2O?CO32-+H3O+为电离方程式,故A不选;
B.H2O+H2O?H3O++OH-为水的电离方程式,故B不选;
C.CO2+H2O?H2CO3为化学平衡,故C不选;
D.CO32-+H2O?HCO3-+OH-为碳酸根离子的水解反应,故D选;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握电离与水解的差别为解答的关键,侧重水解的离子反应考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列过程中,离子键被破坏的是( )
| A. | 溴挥发 | B. | 氯气被木炭吸附 | C. | 硫酸溶于水 | D. | 食盐溶于水 |
1.如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )


| A. | (3)(4)(2)(1) | B. | (3)(1)(4)(2) | C. | (4)(3)(1)(2) | D. | (3)(4)(1)(2) |
18.元素的性质随着原子序数的递增呈现周期性变化的根本原因是( )
| A. | 元素相对原子质量的递增而引起的变化 | |
| B. | 元素的化合价呈周期性的变化 | |
| C. | 元素原子核外电子排布呈周期性的变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
15.下列描述中正确的是( )
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
19.元素A、B、C原子序数之和为36,A、B在同一周期,A+与C2-具有相同的核外电子层结构.下列推测不正确的是( )
| A. | 同周期元素中A的金属性最强 | |
| B. | 原子半径A>B,离子半径A+>C2- | |
| C. | 同族元素中C的氢化物稳定性最高 | |
| D. | 同周期元素中B的最高价含氧酸的酸性最强 |
20. 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测的现象 |
| A | 淀粉KI溶液 | 浓硝酸 | ①中溶液变蓝 |
| B | 浓盐酸 | 浓氨水 | 大烧杯上部出现白烟 |
| C | 酚酞试液 | 浓盐酸 | ①中溶液变红 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |

 .
. .
. .
. ②NaOH
②NaOH ③NH3
③NH3 ④N2
④N2
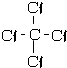 ③NH3
③NH3 ④H2SH-S-H.
④H2SH-S-H.