题目内容
13.已知A、B、C、D、E、F、G、H八种元素位于元素周期表前四周期,其中只有D、E是金属元素且D是地壳中含量最多的金属元素,E的单质是日常生活中用途最广泛的金属.A、B的原子核外电子数和与C原子的核外电子数相等且A、B、C能形成离子化合物.G是B是同周期相邻元素且G原子基态时未成对电子数与其周期序数相等,B与H位于同一主族,D、H、F位于同一周期且原子序数依次增大,F原子的最外电子层上的p电子数是s电子数的两倍.请用化学用语回答以下问题:(1)E的基态电子排布式为1s22s22p63s23p63d64s2.金属E形成的晶体,堆积模型是体心立方堆积方式,则配位数为:8.
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为N>O>P>Al.
(3)A、C、G可形成一种相对分子质量为72的一元羧酸分子,该分子中存在的σ键和π键的数目之比为4:1;
(4)由C、F形成的酸根离子FC32-的VSEPR模型名称是:正四面体,该离子中,F原子的杂化轨道类型:sp3;由A、C、F与钠四种元素按原子个数比为1:3:1:1组成的一种化合物,其水溶液呈酸性的原因是HSO3-电离程度大于水解程度,向该溶液中滴入酸性高锰酸钾溶液时发生反应的离子方程式为H++5HSO3-+2MnO4-=5SO42-+2Mn2++3H2O.
分析 A、B、C、D、E、F、G、H八种元素位于元素周期表前四个周期,其中只有D、E是金属元素,且D是地壳中含量最多的金属元素,E的单质是日常生活中用途最广泛的金属,则D为Al,E为Fe;D、H、F位于同一周期且原子序数依次增大,即位于第三周期,F原子的最外电子层上的p电子数是s电子数的两倍,其核外电子排布为1s22s22p63s23p4,故F为S元素;A、B的原子核外电子数和与C原子的核外电子数相等且A、B、C能形成离子化合物,该离子化合物应是NH4NO3,C为O元素,B与H位于同一主族,则B为N元素,A为H元素,可推知H为P元素;G是B是同周期相邻元素且G原子基态时未成对电子数与其周期序数相等,核外电子排布为1s22s22p2,故G为碳元素,据此解答.
解答 解:A、B、C、D、E、F、G、H八种元素位于元素周期表前四个周期,其中只有D、E是金属元素,且D是地壳中含量最多的金属元素,E的单质是日常生活中用途最广泛的金属,则D为Al,E为Fe;D、H、F位于同一周期且原子序数依次增大,即位于第三周期,F原子的最外电子层上的p电子数是s电子数的两倍,其核外电子排布为1s22s22p63s23p4,故F为S元素;A、B的原子核外电子数和与C原子的核外电子数相等且A、B、C能形成离子化合物,该离子化合物应是NH4NO3,C为O元素,B与H位于同一主族,则B为N元素,A为H元素,可推知H为P元素;G是B是同周期相邻元素且G原子基态时未成对电子数与其周期序数相等,核外电子排布为1s22s22p2,故G为碳元素.
(1)E为Fe,Fe的基态原子的电子排布式为:1s22s22p63s23p63d64s2,Fe是体心立方密堆积,配位数为8,故答案为:1s22s22p63s23p63d64s2;8;
(2)同主族元素从上到下,元素的第一电离能逐渐减小,同周期元素从左到右,元素的第一电离能逐渐增大,由于N的2p轨道为半充满状态,较稳定,所以N的第一电离能大于O,而O元素非金属性远强于P,故O元素第一电离能高于P,则第一电离能:N>O>P>Al,故答案为:N>O>P>Al;
(3)H、O、C可形成一种相对分子质量为72的一元羧酸分子,该羧酸为CH2=CHCOOH,分子中含有8个σ键和2个π键,二者比值为4:1,故答案为:4:1;
(4)由C、F形成的酸根离子SO32-中S原子价层电子对数为3+$\frac{6+2-2×3}{2}$=4,VSEPR模型名称是:正四面体,该离子中S原子的杂化轨道类型:sp3;
由H、O、S与钠四种元素按原子个数比为l:3:1:1组成一种化合物为NaHSO3,其水溶液呈酸性,说明HSO3-电离程度大于水解程度,向该溶液中滴入酸性高锰酸钾溶液时发生反应的离子方程式为:H++5HSO3-+2MnO4-=5SO42-+2Mn2++3H2O,
故答案为:正四面体;sp3;HSO3-电离程度大于水解程度;H++5HSO3-+2MnO4-=5SO42-+2Mn2++3H2O.
点评 本题考查结构性质位置关系综合应用,题目比较综合,正确推断元素的种类为解答该题的关键,需要学生具备扎实的基础,题目难度中等.

| A. | 0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| B. | 已知酸性HF>CH3COOH,则pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-)=c(K+)-c(CH3COO-) | |
| C. | 0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸pH=b,则a+1=b | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c(NH4Cl)<c[(NH4)2CO3]<c[(NH4)2SO4] |
| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl-) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
| A. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)═c(SO32-)-2(H2SO3) | |
| B. | 1 L 0.1 mol•L-1的(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| D. | 向0.01 mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(SO42-)>c(Na+)═c(NH4+)>c(OH-)=c(H+) |
| A. | 葡萄糖可以发生氧化反应、银镜反应和水解反应 | |
| B. | 工业上利用油脂在碱性条件下的水解反应制取肥皂 | |
| C. | 食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体营养物质 | |
| D. | 甲醛对人体有害,但甲醛的水溶液可用于标本的防腐 |
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸可与3mol NaOH发生中和反应 | |
| B. | 1mol苹果酸与足量金属Na反应生成1molH2 | |
| C. | 苹果酸分子的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
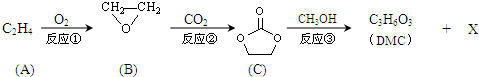
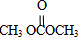 ;XOHCH2CH2OH;
;XOHCH2CH2OH;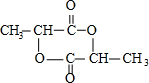 ;
;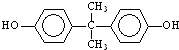 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n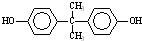 →
→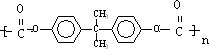 +4nCH3OH.
+4nCH3OH. 氟是非金属性最强的元素:回答下列问题:
氟是非金属性最强的元素:回答下列问题: ,其中氧原子采用的轨道杂化方式是sp3,氟元素的化合价是-1.
,其中氧原子采用的轨道杂化方式是sp3,氟元素的化合价是-1.