题目内容
1.下列溶液中有关微粒的物质的量浓度关系正确的是( )| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl-) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
分析 A.二者反应生成等浓度的硫酸钠和硫酸铵,铵根离子部分水解,溶液显示酸性,则c(H+)>c(OH-);
B.反应后的溶液为中性,则c(H+)=c(OH-),然后结合物料守恒和电荷守恒进行判断;
C.根据混合液中的物料守恒判断;
D.根据硫酸氢钠溶液中的电荷守恒判断.
解答 解:A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合,反应后溶质为等浓度的硫酸钠和硫酸铵,由于铵根离子部分水解,溶液呈酸性,则:c(H+)>c(OH-)、c(Na+)=c(SO42-)>c(NH4+),正确的离子浓度大小为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得:c(H+)+c(Na+)=c(Cl-)+c(OH-)+c(CH3COO-),所以c(Na+)>c(Cl-),根据物料守恒得:c(Na+)=c(CH3COOH)+c(CH3COO-),故c(Cl-)=c(CH3COOH),所以溶液中存在离子浓度大小顺序为:c(Na+)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-),故B正确;
C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中,根据物料守恒可得:2c(HClO)+2c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-),故C错误;
D.NaHSO4溶液中,根据电荷守恒可得:c(Na+)+c(H+)═2c(SO42-)+c(OH-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成及电荷守恒、物料守恒、盐的水解原理的含义为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
9.设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 6.02×1023就是阿伏加德罗常数 | |
| B. | 1 mol H2O中的氢原子数目为2NA | |
| C. | 阿伏加德罗常数个粒子的物质的量是1mol | |
| D. | 1mol NH3所含原子数约为2.408×1024个 |
12.某无色溶液呈强酸性,则下列各组离子一定可以大量存在的是( )
| A. | Mg2+、Al3+、HCO3-、Cl- | B. | Na+、Cu2+、Cl-、SO42- | ||
| C. | K+、NH4+、Cl-、SO42- | D. | Ba2+、Fe2+、Cl-、NO3- |
9.现有常温下pH均等于5的HCl溶液和NH4Cl溶液,下列说法正确的是( )
| A. | 两溶液中n (H+)相等 | B. | 两溶液中c(Cl-)相等 | ||
| C. | 两溶液中c(OH-)相等 | D. | 两溶液中水的电离程度相等 |
16.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硫原子的结构示意图: | |
| C. | 基态188O的电子排布式:1s22s22p63s23p6 | |
| D. | 过氧化钠的电子式: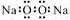 |
10.下列化学用语使用正确的是( )
| A. | 14C原子结构示意图: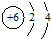 | B. | 硝基苯的结构简式: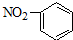 | ||
| C. | CO2的电子式: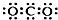 | D. | CH4分子的球棍模型: |
 ;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.
;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.