题目内容
8.已知KMnO4与KNO2溶液反应的离子方程式为(未配平):MnO4-+NO2-+□-Mn2++NO3-+H2O.下列说法正确的是( )| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
分析 该反应中Mn元素化合价由+7价变为+2价,所以MnO4-是氧化剂,NO2-应该作还原剂,亚硝酸根离子中N元素应该失电子化合价升高,酸性条件下,应该生成硝酸根离子,根据转移电子相等、原子守恒配平方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O,以此解答该题.
解答 解:该反应中Mn元素化合价由+7价变为+2价,所以MnO4-是氧化剂,NO2-应该作还原剂,亚硝酸根离子中N元素应该失电子化合价升高,酸性条件下,应该生成硝酸根离子,根据转移电子相等、原子守恒配平方程式为2MnO4-+5NO2-+6H+=2Mn2++5 NO3-+3H2O,
A.反应中Mn元素化合价降低,MnO4-发生还原反应,故A错误;
B.由方程式可知氧化剂与还原剂的物质的量之比为2:5,故B错误;
C.方程式“□”中的应填入H+,故C错误;
D.由方程式可知氧化产物与还原产物物质的量之比是5:2,故D正确.
故选D.
点评 本题考查氧化还原反应,根据高锰酸钾的性质确定NO2-的性质,正确配平方程式是解本题关键,易错选项是C,注意从电荷生成的角度判断,为易错点.

练习册系列答案
相关题目
16.下列反应属于非氧化还原反应的是( )
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;△\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CuO+CO═Cu+CO2 |
19.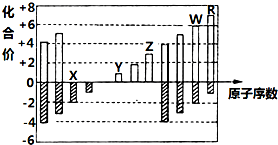 如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
 如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )| A. | 原子半径比较:Z>Y>X | |
| B. | 最高价氧化物对应的水化物的酸性比较:W>R | |
| C. | X和Y形成的化合物中只含离子键 | |
| D. | Z的氧化物和Y的 最高价氧化物对应的水化物能反应 |
16.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硫原子的结构示意图: | |
| C. | 基态188O的电子排布式:1s22s22p63s23p6 | |
| D. | 过氧化钠的电子式: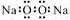 |
18.一定条件密闭容器中发生如下反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H<0,下列有关描述中正确的是( )
| A. | 升高温度,上述反应的平衡常数增大 | |
| B. | 其他条件不变,压缩容器,V正、V逆均增大 | |
| C. | 保持容器的容积不变,向密闭容器中充入CO2,平衡逆向移动 | |
| D. | 保持体系的压强不变,向密闭容器中充入氦气,平衡正向移动 |
 有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知:
有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知: