题目内容
5. 氟是非金属性最强的元素:回答下列问题:
氟是非金属性最强的元素:回答下列问题:(1)写出基态氟原子的电子排布式1s22s22p5,该电子排布的最高能级的电子云形状是哑铃形,该能级电子云在坐标里有3个相互垂直的取向.
(2)O3F2的结构式为
 ,其中氧原子采用的轨道杂化方式是sp3,氟元素的化合价是-1.
,其中氧原子采用的轨道杂化方式是sp3,氟元素的化合价是-1.(3)1951年,化学家首次在实验室中合成了FClO3气体,该气体分子的立体构型是(氯原子为中心原子)四面体.
(4)单质氟可通过电解法来制备.实验室中则用加热六氟合铅酸钠(Na2PbF6)分解制备,已知反应中n(Na2PbF6):n(F2)=1:1,该反应的化学方程式为Na2PbF6$\frac{\underline{\;\;△\;\;}}{\;}$Na2PbF4+F2↑.
(5)氟化氢气体溶于水得氢氟酸.解释下列事实:
①常压、80℃以下,测量氟化氢气体密度后计算其相对分子质量,实验值明显大于理论值,原因是常压时,在80℃以下,HF分子之间存在氢键形成缔合(HF)n分子.
②氢氟酸属于弱酸,但浓的氢氟酸由于电离方式改变导致酸性变强(2HF?H++HF${\;}_{2}^{-}$),其电离方式改变的原因是在氟化氢浓溶液中,电离产生的F-通过氢键与未电离的HF结合生成HF2-等缔合离子.
(6)CaF2晶胞如图,钙离子的配位数为8,每个氟离子填充在由钙离子构成的四面体空隙中,每个钙离子周围最近且等距的钙离子数目是12.
分析 (1)F原子核外有9个电子,根据能量最低原理书写核外电子排布式;其最高能级为2p能级;
(2)氧原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4;F元素电负性大于O元素,共用电子对偏向F元素;
(3)Cl原子形成4个σ键,没有孤电子对,为四面体构型;
(4)由原子守恒可知,Na2PbF6分解反应生成Na2PbF4与F2;
(5)①HF分子之间存在氢键形成缔合(HF)n分子;
②电离产生的F-与HF通过氢键结合生成HF2-等缔合离子;
(6)晶胞中黑色球数目为8,白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故黑色球为氟离子、白色球为钙离子,以上底面面心钙离子研究,钙离子为两个晶胞共用,每个钙离子周围有8个氟离子;
每个氟离子填充在由钙离子构成的四面体的体空隙中;
与顶点钙离子研究,与之最近且等距离的钙离子为面心.
解答 解:(1)F原子核外有9个电子,根据能量最低原理,核外电子排布式为1s22s22p5;其最高能级为2p能级,电子云形状是哑铃形,该能级电子云在坐标里有3个相互垂直的取向,
故答案为:1s22s22p5;哑铃形;3;
(2)氧原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4,氧原子采取sp3杂化;F元素电负性大于O元素,共用电子对偏向F元素,故F元素表现-1价,
故答案为:sp3;-1;
(3)Cl原子形成4个σ键,没有孤电子对,为四面体构型,故答案为:四面体;
(4)由原子守恒可知,Na2PbF6分解反应生成Na2PbF4与F2,反应方程式为:Na2PbF6$\frac{\underline{\;\;△\;\;}}{\;}$Na2PbF4+F2↑,
故答案为:Na2PbF6$\frac{\underline{\;\;△\;\;}}{\;}$Na2PbF4+F2↑;
(5)①常压时,在80℃以下,HF分子之间存在氢键形成缔合(HF)n分子,故HF相对分子质量的实验值明显大于理论值,
故答案为:常压时,在80℃以下,HF分子之间存在氢键形成缔合(HF)n分子;
②在氟化氢浓溶液中,电离产生的F-通过氢键与未电离的HF结合生成HF2-等缔合离子,其电离方式改变,
故答案为:在氟化氢浓溶液中,电离产生的F-通过氢键与未电离的HF结合生成HF2-等缔合离子;
(6)晶胞中黑色球数目为8,白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故黑色球为氟离子、白色球为钙离子,以上底面面心钙离子研究,钙离子为两个晶胞共用,每个钙离子周围有8个氟离子;
每个氟离子填充在由钙离子构成的四面体体空隙中;
与顶点钙离子研究,与之最近且等距离的钙离子为面心,每个顶点为12面共用,故每个钙离子周围最近且等距的钙离子数目是12,
故答案为:8;四面;12.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、分子构型、氢键、晶胞结构与计算等,需要学生具备扎实的基础与灵活运用能力,难度中等.

| A. | 锌锰干电池工作一段时间后锌皮变薄 | |
| B. | 铅蓄电池工作一段时间后两极板质量都增加 | |
| C. | 氢氧燃料电池将电能直接转变为化学能 | |
| D. | 银锌纽扣电池工作一段时间后有银单质生成 |
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硫原子的结构示意图: | |
| C. | 基态188O的电子排布式:1s22s22p63s23p6 | |
| D. | 过氧化钠的电子式: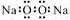 |
| A. | 14C原子结构示意图: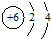 | B. | 硝基苯的结构简式: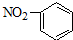 | ||
| C. | CO2的电子式: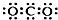 | D. | CH4分子的球棍模型: |
| A. | 糖类、油脂和蛋白质均可发生水解反应 | |
| B. | 乙酸和乙酸乙酯可用Na2CO3溶液区别 | |
| C. | 棉花、羊毛、蚕丝均属于天然纤维素 | |
| D. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |

| A. | 分子式为C7H10O5 | |
| B. | 分子中含有3种官能团 | |
| C. | 可发生加成反应和酯化反应 | |
| D. | 在水溶液中羧基和羟基均能电离出H+而使溶液显酸性 |
 有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知:
有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知: