题目内容
18.下列溶液中微粒间的物质的量浓度关系正确的是( )| A. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)═c(SO32-)-2(H2SO3) | |
| B. | 1 L 0.1 mol•L-1的(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| D. | 向0.01 mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(SO42-)>c(Na+)═c(NH4+)>c(OH-)=c(H+) |
分析 A、根据电荷守恒得c( Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),根据物料守恒得c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),所以得c(H2SO3)+c(H+)=c(SO32-)+c(OH-);
B、1L0.1mol•L-1(NH4)2Fe(SO4)2溶液中铵根离子浓度大于亚铁离子浓度,水解显酸性,得到溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
C、pH相等的这几种物质,NaOH的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小,pH相等的CH3COONa、NaOH和NaCO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa);
D、如果NH4HSO4与NaOH完全反应,化学计量比是1:2,但若完全反应溶液中有较多的NH3.H2O,会显碱性,想使溶液为中性,NH4HSO4必须有剩余,若NH4HSO4与NaOH1:1反应,那么溶液中还有很多NH4+,溶液显示酸性(NH4+水解显酸性),所以若NH4HSO4为1mol,设与之反应的NaOH的用量xmol,则有1<x<2,则NH4+的量<1.假设溶液体积为1升,反应结束后,SO42-的量为n=0.01mol/l,Na+的量为x(0.01<x<0.02),NH4+的量为y<0.01,由于是中性,所以H+和OH-的量相同,均为10-7;
解答 解;A、根据电荷守恒得c( Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),根据物料守恒得c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),所以得c(H2SO3)+c(H+)=c(SO32-)+c(OH-),所以c(H+)-c(OH-)═c(SO32-)-(H2SO3),故A错误;
B、1L0.1mol•L-1(NH4)2Fe(SO4)2溶液中铵根离子浓度大于亚铁离子浓度水解显酸性得到溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故B正确;
C、pH相等的这几种物质,NaOH的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小,pH相等的CH3COONa、NaOH和NaCO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa),故C错误;
D、如果NH4HSO4与NaOH完全反应,化学计量比是1:2,但若完全反应溶液中有较多的NH3.H2O,会显碱性,想使溶液为中性,NH4HSO4必须有剩余,若NH4HSO4与NaOH1:1反应,那么溶液中还有很多NH4+,溶液显示酸性(NH4+水解显酸性),所以若NH4HSO4为1mol,设与之反应的NaOH的用量xmol,则有1<x<2,则NH4+的量<1.假设溶液体积为1升,反应结束后,SO42-的量为n=0.01mol/l,Na+的量为x(0.01<x<0.02),NH4+的量为y<0.01,由于是中性,所以H+和OH-的量相同,均为10-7,所以离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D错误;
故选B.
点评 本题考查离子浓度大小比较,明确物质的性质、溶液酸碱性结合守恒思想分析解答,综合性强有一定的难度.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案| A. | 水高温条件下不易分解,是因为水分子内的H-O稳定 | |
| B. | 互为同分异构体的物质性质一定相似 | |
| C. | 分子组成若干个“CH12”原子团的有机化合物互称为同系物 | |
| D. | 因为互为同位素的核素的性质完全相同,所以这些核素在元素周期表中占据相同位置 |
| A. | 两溶液中n (H+)相等 | B. | 两溶液中c(Cl-)相等 | ||
| C. | 两溶液中c(OH-)相等 | D. | 两溶液中水的电离程度相等 |
| A. | 14C原子结构示意图: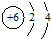 | B. | 硝基苯的结构简式: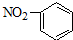 | ||
| C. | CO2的电子式: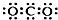 | D. | CH4分子的球棍模型: |
| A. | 只含碳、氢两种元素,不含氧元素 | |
| B. | 肯定含碳、氢两种元素,可能含氧 | |
| C. | 含碳、氢两种元素,其质量比是11:9 | |
| D. | 含碳、氢、氧三种元素,其质量比为3:1:4 |

后者可溶于质量分数大于98%的硫酸,而前者不能.利用这一性质可以将这二种异构体分离.在上述硝化产物中加入适量的98.3%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是( )
| A. | 对所得的滤液蒸发浓缩冷却结晶 | |
| B. | 向滤液中缓缓加入水后过滤 | |
| C. | 将滤液缓缓加入水中后过滤 | |
| D. | 向滤液中缓缓加入Na2CO3溶液后过滤 |
 ;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.
;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml. .
.
 .
. .
. .
.