题目内容
20.某溶液中,可能含有以下离子中的若干种:Cl-,Mg2+,Ba2+,CO32-,SO42-,Na+现取相同质量的两份各加100mL溶液进行如下实验:第一份加入硝酸银溶液有沉淀
第二份加入足量的氯化钡溶液,得沉淀物8.6g,经足量硝酸洗涤干燥后,沉淀质量为4.66g,在所得滤液中加入硝酸银溶液有沉淀生成.根据上述实验判断:
(1)肯定存在的离子有Na+、CO32-、SO42-,肯定不存在的离子有Mg2+、Ba2+,可能存在的离子有Cl-.写出8.6g沉淀物被硝酸溶解时发生的离子方程式BaCO3+2H+═Ba2++H2O+CO2↑.
(2)100mL溶液中Na+的物质的量为≥0.08mol.
分析 ①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②4.66g为硫酸钡沉淀,其物质的量为0.02mol,8.6g为硫酸钡和碳酸钡,据此可以计算出碳酸钡的物质的量;
再根据电荷守恒,得出一定存在钠离子,据此进行判断.
解答 解:①与AgNO3溶液有沉淀产生的离子有Cl-、CO32-、SO42-;
②不溶于硝酸的4.66g沉淀为硫酸钡,硫酸钡的物质的量是:$\frac{4.66g}{233g/mol}$=0.02mol;8.6g沉淀是硫酸钡和碳酸钡,碳酸钡质量为:8.6g-4.66g=3.94g,碳酸钡物质的量为:$\frac{3.94g}{197g/mol}$=0.02mol,所以原溶液中一定存在:CO32-、SO42-,因而一定没不含Ba2+和Mg2+,由溶液电中性原则可知,一定存在Na+,
c(CO32-)=c(SO42-)=$\frac{0.02mol}{0.1L}$=0.2mol/L,再根据电荷守恒,正电荷为:n(+)=n(Na+)=0.08mol;
(1)根据以上分析可知:原溶液中一定存在的离子有Na+、CO32-、SO42-,一定没有的离子Mg2+、Ba2+,可能存在Cl-,碳酸钡与硝酸反应生成硝酸钡、二氧化碳气体和水,离子反应方程式为:BaCO3+2H+═Ba2++H2O+CO2↑,故答案为:Na+、CO32-、SO42-;Mg2+、Ba2+;Cl-;BaCO3+2H+═Ba2++H2O+CO2↑;
(2)n(Na+)=2n(CO32-)+2n(SO42-)=0.02×2+0.02×2=0.08mol,若存在氯离子,那么钠离子>0.08mol,故答案为:≥0.08.
点评 本题考查离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是K+的确定易出现失误.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | C3H6不只表示一种物质 | |
| D. | 烯烃中各同系物中碳的质量分数相同 |
| A. | 负极反应Al-3e-Al3+ | B. | 燃料气体是氧气 | ||
| C. | 正极反应为2CO2+O2+4e-2CO32- | D. | 该电池不能用烃类物质作燃料 |
| A. | 将CH3CH2Br与NaOH溶液共热,冷却,取上层溶液加AgNO3溶液,观察是否产生淡黄色沉淀,检验CH3CH2Br与NaOH溶液是否发生反应 | |
| B. | 在实验室,将乙醇和浓硫酸的混合物共热发生反应,生成能使酸性KMnO4溶液褪色的气体,此气体一定是乙烯 | |
| C. | 室温下向苯和少量苯酚的混合液中加入适量烧碱溶液,振荡、静置后分液,可除去其中的苯酚 | |
| D. | 将硝酸银溶液和少量乙醛于试管中充分混合后,把试管放在热水浴中加热,在试管内壁上有光亮的银镜出现 |
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 氢氧燃料电池可将热能直接转变为电能 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被氧化 |
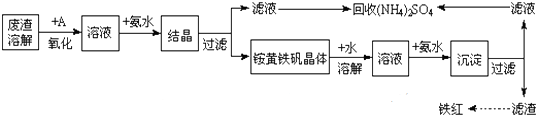
I.向铝灰中加入过量稀H2SO4,过滤;
II.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
III.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
IV.加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品.
(1)步骤Ⅰ过滤得到沉淀的主要成分SiO2(填化学式),H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤II的目的pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(3)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{乙醇}$CH3CH═CH2↑+NaBr+H2O | |
| C. | 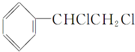 +2NaOH$→_{△}^{乙醇}$ +2NaOH$→_{△}^{乙醇}$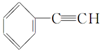 +2NaCl+2H2O +2NaCl+2H2O | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
| A. | 不同的原子 | B. | 同一元素的不同原子或离子 | ||
| C. | 不同元素的离子 | D. | 不同的元素 |