题目内容
20.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的概念及要求.理想的“原子经济性”反应中,原料分子中的所有原子全部转变成所需产物,不产生副产物,实现零排放.以下反应中符合“原子经济性”的是( )| A. | 乙醇催化氧化制乙醛 | B. | 乙醇与浓硫酸共热制乙烯 | ||
| C. | 乙烷与氯气反应制氯乙烷 | D. | 苯乙烯在一定条件下制聚苯乙烯 |
分析 根据绿色化学的定义可知,原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放,以此解答该题.
解答 解:A、乙醇催化氧化制乙醛,同时生成水,原子没有全部利用,故A错误;
B、乙醇与浓硫酸共热制乙烯,同时生成水,原子没有全部利用,故B错误;
C、乙烷与氯气反应除生成氯乙烷外,还有二氯乙烷、三氯乙烷、四氯乙烷等副产物,含有HCl生成,原子利用率不是100%,故C错误;
D、苯乙烯在一定条件下制聚苯乙烯,原料中的原子全部转变成所需要的产物,不产生副产物,实现零排放,故D正确;
故选D.
点评 绿色化学实质是原子利用率是100%,全部转变成所需要的产物,从源头上做起,不浪费、不污染.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
10.写出下列分子中中心原子的杂化方式与分子空间构型
| 中心原子杂化方式 | 分子空间构型 | |
| NH3 | sp3 | 三角锥形 |
| BF3 | sp2 | 平面正三角形 |
| H2O | sp3 | V形 |
11.下列说法中,正确的是( )
| A. | CO2的摩尔质量为44g | |
| B. | 1molN2的质量是14g | |
| C. | 标准状况下,1molCO2所占的体积约是22.4L | |
| D. | 将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L |
8.下列关于物质性质变化的比较,不正确的是( )
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 还原性强弱:Cl-<Br-<I- | D. | 碱性强弱:KOH>NaOH>LiOH |
5.已知元素的原子序数,可以推知该元素原子的( )
①中子数 ②质子数 ③核电荷数 ④质量数 ⑤核外电子数.
①中子数 ②质子数 ③核电荷数 ④质量数 ⑤核外电子数.
| A. | ①②③ | B. | ①③⑤ | C. | ②③④ | D. | ②③⑤ |
12.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、SO42-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
12.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图2
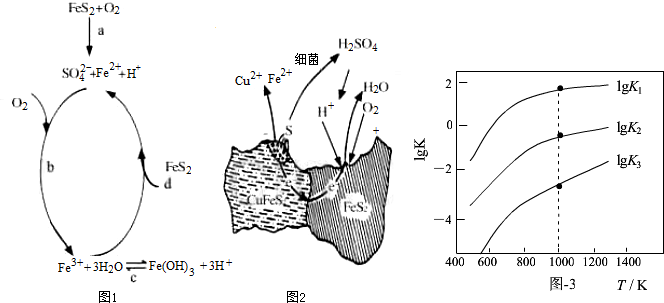
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图3.
①上述反应中,△H1>0(选填:“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图2

①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图3.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.

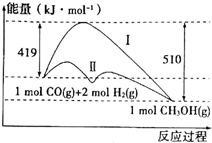 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.