题目内容
4.已知CaCO3(s)═CaO(s)+CO2(g)的Kc=0.50(1500K),在此温度下,CO2又有部分分解成CO,即CO2(g)═CO(g)+$\frac{1}{2}$O2(g).若将1.0mol CaCO3(g)装入1.0dm3真空容器中,加热到1500K平衡,气体中O2的摩尔分数(物质的量分数)为0.15,求此时CaO的物质的量.分析 设生成的CaO为xmol,生成氧气为ymol,
CaCO3(s)═CaO(s)+CO2(g)
起始(mol)1.0
剩余(mol)1.0-x x x
CO2(g)═CO(g)+$\frac{1}{2}$O2(g)
起始(mol)x
剩余(mol)x-2y 2y y
根据平衡时Kc和气体中O2的摩尔分数(物质的量分数)计算.
解答 解:设生成的CaO为xmol,生成氧气为ymol,
CaCO3(s)═CaO(s)+CO2(g)
起始(mol)1.0
剩余(mol)1.0-x x x
CO2(g)═CO(g)+$\frac{1}{2}$O2(g)
起始(mol)x
剩余(mol)x-2y 2y y
已知Kc=c(CO2)=$\frac{x-2y}{1}$=0.50,
已知平衡时气体中O2的摩尔分数(物质的量分数)为0.15,
则$\frac{y}{x-2y+2y+y}$=0.15,
所以x=0.636,y=0.136.
答:此时CaO的物质的量0.636mol.
点评 本题考查了化学平衡的有关计算,题目难度中等,注意根据已知的方程式和平衡常数计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.根据元素的核电荷数,不能确定的是( )
| A. | 原子核内质子数 | B. | 原子核中子数 | C. | 核外的价电子数 | D. | 原子的电子数 |
12.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、SO42-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 透明溶液中:K+、Cu2+、SO42-、Cl- | |
| B. | KI水溶液中:K+、NO3-、SO42-、H+ | |
| C. | 使紫色石蕊试液变蓝色的溶液:K+、Na+、HS-、Cl- | |
| D. | 水电离出的c(H+)=1×10-14mol•L-1的溶液:K+、NH4+、AlO2-、Br- |
15.下列说法中,不正确的是( )
| A. | 反应热指的是反应过程中放出的热量 | |
| B. | 原电池的负极发生氧化反应 | |
| C. | 伴随能量变化的不一定是化学变化 | |
| D. | 电解池的阳极发生氧化反应 |
16.如图,下列装置属于原电池的是( )
| A. | 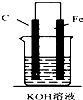 | B. | 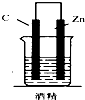 | C. | 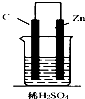 | D. |  |

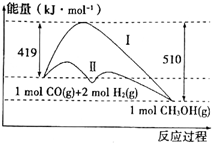 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.