题目内容
8.写出下列物质的电子式.Na2O
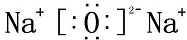 NaOH
NaOH Na2O2
Na2O2
NH3
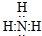 CO2
CO2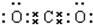 HClO
HClO .
.
分析 氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
氨气中存在3个氮氢键,氮原子最外层8个电子;
二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键.
解答 解:氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: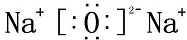 ;
;
氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ;
;
Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
氨气中存在3个氮氢键,氮原子最外层8个电子,氨气的电子式为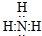 ;
;
CO2为共价化合物,二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: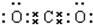 ;
;
HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ;
;
故答案为: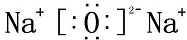 ;
; ;
; ;
;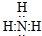 ;
;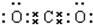 ;
; .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及正确的表示方法,明确离子化合物中阴离子需要标出最外层电子,阳离子直接用离子符号表示.

练习册系列答案
相关题目
11.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | NH4Cl溶于重水(D2O)生成NH3D2O和HD2O+ | |
| D. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
19.已两种气态烃以任意比例混合,在105℃时,1L该混合烃与9L氧气混合,充分燃烧,恢复到原状态,所得气体仍为10L,则这两种烃不可能是( )
| A. | CH4和C2H4 | B. | CH4和C3H6 | C. | C2H4和C3H4 | D. | C2H2和C3H6 |
16.常见的离子晶体类型有五种,右图是其中的一种空间构型.则该晶体的化学式可能为( )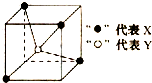

| A. | YX4 | B. | XY2 | C. | YX | D. | YX2 |
3.下列各种气体中,其中易液化,遇挥发性酸时冒白烟,而且适宜作致冷剂的是( )
| A. | N2 | B. | NO | C. | NH3 | D. | NO2? |
13.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA | |
| B. | 1mol/LFeCl3 溶液中所含Fe3+的数目小于NA | |
| C. | 常温下,1L pH=12的Ba(OH)2 溶液中含OH-的数目为2NA | |
| D. | 23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |
20.(A)下列各种叙述中正确的是( )
| A. | 在CH2=CH2分子中,存在五个s-sp2σ键和一个π键 | |
| B. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| C. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 | |
| D. | 在共价化合物中,一定存在极性共价键,可能存在非极性共价键,一定不存在离子键 |
17.有关能源的下列说法不正确的是( )
| A. | 煤、石油、天然气都是化石能源 | |
| B. | 氢能、核能都是无污染的可再生能源 | |
| C. | 氢能是可再生能源 | |
| D. | 化石能源是非再生能源 |
18.欲得到较纯净氯乙烷的方法是( )
| A. | 乙烷与氯气发生取代反应 | B. | 乙烯与氯气发生加成反应 | ||
| C. | 乙烯与氯化氢发生加成反应 | D. | 乙炔与氯化氢发生加成反应 |