题目内容
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)简称“三盐”,不溶于水及有机溶剂。以铅泥(PbSO4、PbO、Pb及其他杂质等)为原料制备三盐的工艺流程如下图所示
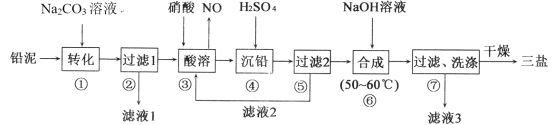
已知:KSP(PbSO4)=1.82×10-8,KSP(PbCO3)=1.46×10-13请回答下列问题:
(1)写出步骤①“转化”的主要离子方程式_______。
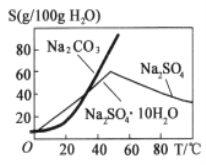
(2)根据图溶解度曲线,由滤液I得到Na2SO4固体的操作为:将“滤液1”________、______、用乙醇洗涤后干燥。
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是____________(任意写出一条)
(4)“滤液2”中可循环利用的溶质为___(填化学式)。若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5 mol·L-1,则此时c(SO42-)=____mol·L-1。
(5)步骤⑥“合成”三盐的化学方程式为___________。
(6)若消耗100 t铅泥,最终得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有75.0%转化为三盐,则铅泥中铅元素的质量分数为___。
【答案】PbSO4+ CO32-=PbCO3+ SO4 2- 50℃以上蒸发结晶 趁热过滤 适当升温(适当增加硝酸浓度,或将滤渣粉碎,增大表面积等) HNO3 1×10-3 4PbSO4+6NaOH![]() 3PbOPbSO4H2O +3Na2SO4+2H2O 55.2%
3PbOPbSO4H2O +3Na2SO4+2H2O 55.2%
【解析】
以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐,由流程可知,向铅泥中加Na2CO3溶液是将PbSO4转化成PbCO3,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,Pb、PbO和PbCO3在硝酸的作用下反应:3Pb+8HNO3=Pb(NO3)2+2NO↑+4H2O、PbCO3+2HNO3=Pb(NO3)2+CO2↑+H2O、PbO+2HNO3=Pb(NO3)2+2H2O,均转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,过滤的滤液为HNO3,可循环利用,向硫酸铅中加入氢氧化钠合成三盐和硫酸钠,发生4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此来解答。
3PbOPbSO4H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此来解答。
(1)步骤①向铅泥中加Na2CO3溶液,由表可知PbCO3的溶解度小于PbSO4的溶解度,发生Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),其离子方程式为CO32-(aq)+PbSO4(s)=SO42-+PbCO3(s);
(2)图2中硫酸钠的溶解度在温度高时溶解度小,则由滤液1得到Na2SO4固体的操作为:将“滤液1”升温结晶、趁热过滤,用乙醇洗涤后干燥;
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是适当升温(或增大硝酸浓度、减小颗粒大小等);
(4)Pb、PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,“滤液2”中可循环利用的溶质为HNO3,若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5molL-1,则此时c(SO42-)=![]() =1×10-3molL-1;
=1×10-3molL-1;
(5)步骤⑥“合成”三盐的化学方程式为4PbSO4+6NaOH![]() 3PbOPbSO4H2O+3Na2SO4+2H2O,;
3PbOPbSO4H2O+3Na2SO4+2H2O,;
(6)若得到纯净干燥的三盐49.5t,则其中铅元素的质量为![]() ×49.5t=41.4t,设铅泥中铅元素的质量分数为w,则100.0t铅泥中铅元素为100×w,铅泥中的铅元素有75%转化为三盐,有100×w×75%=41.4,解得x=55.20%。
×49.5t=41.4t,设铅泥中铅元素的质量分数为w,则100.0t铅泥中铅元素为100×w,铅泥中的铅元素有75%转化为三盐,有100×w×75%=41.4,解得x=55.20%。

【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
实验 | 试剂 | 编号及现象 | |
滴管 | 试管 | ||
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 实验I:溶液变为浅红色,微热后红色加深 |
1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 实验II:开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验III:无明显变化 | |
1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验IV:溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红 | |
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)结合化学用语解释实验I“微热后红色加深”的原因 ______
(2)实验II证明NO2-具有_____性, 从原子结构角度分析原因_________
(3)探究实验IV中的棕色溶液
①为确定棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 编号及现象 |
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速变为___色 |
___________________ | ii.无明显变化 |
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因_________。
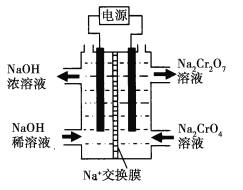
(4)络合反应导致反应物浓度下降,干扰实验IV中氧化还原反应发生及产物检验。小组同学设计实验V:将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大。
①盐桥的作用是____________________________
②电池总反应式为______________________
实验结论:NO2-在一定条件下体现氧化性或还原性,氧还性强弱与溶液酸碱性等因素有关。