题目内容
【题目】下列图示与对应的叙述不相符的是
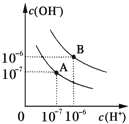
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
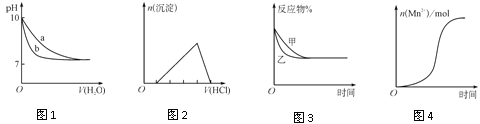
B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C.图3表示压强对可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的影响,乙的压强比甲的压强大
CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
【答案】B
【解析】
A.初始时NaOH溶液和氨水的c(OH-)相等,加水稀释过程中c(OH-)逐渐减小,pH逐渐减小,但氨水是弱碱存在电离平衡NH3![]() H2O
H2O![]() NH4++OH-,稀释过程中电离平衡正向移动,所以稀释相同倍数时氨水中c(OH-)减小的幅度比NaOH小,pH变化曲线平缓些,所以曲线a表示氨水稀释时pH的变化曲线,无限稀释后两溶液pH都接近7,图1符合对应的叙述,A项正确;
NH4++OH-,稀释过程中电离平衡正向移动,所以稀释相同倍数时氨水中c(OH-)减小的幅度比NaOH小,pH变化曲线平缓些,所以曲线a表示氨水稀释时pH的变化曲线,无限稀释后两溶液pH都接近7,图1符合对应的叙述,A项正确;
B.向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸,盐酸先与NaOH反应,没有沉淀产生,NaOH耗尽后盐酸再与NaAlO2反应:NaAlO2+HCl+H2O=Al(OH)3![]() +NaCl,继续滴加盐酸沉淀溶解:Al(OH)3+3HCl=AlCl3+3H2O,由方程式的计量关系知,生成沉淀消耗的HCl的量与溶解这些沉淀消耗盐酸量之比1:3,与图2不符,B项错误;
+NaCl,继续滴加盐酸沉淀溶解:Al(OH)3+3HCl=AlCl3+3H2O,由方程式的计量关系知,生成沉淀消耗的HCl的量与溶解这些沉淀消耗盐酸量之比1:3,与图2不符,B项错误;
(3)从图3看,甲、乙起始反应物含量相同,一段时间后达到平衡(拐点后平行于时间轴的状态),甲、乙平衡状态相同,但乙达到平衡所用时间短,乙的反应速率快。再分析反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)该反应气体体积不变,根据勒夏特列原理,压强改变平衡不移动,加压反应速率增大,说明乙的压强比甲大,图3与叙述相符,C项正确;
CO2(g)+H2(g)该反应气体体积不变,根据勒夏特列原理,压强改变平衡不移动,加压反应速率增大,说明乙的压强比甲大,图3与叙述相符,C项正确;
D. KMnO4酸性溶液与H2C2O4溶液发生氧化还原反应生成Mn2+,Mn2+对该反应有催化作用,所以,反应开始后产生一定量的Mn2+,反应速率迅速增大,一段时间后浓度大幅度减小,浓度的减小成为影响反应速率的主要因素,反应速率减慢,图4符合对应的叙述,D项正确;
答案选B。

【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为__________。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=______________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=______________。
②该反应的△H________0(填“>”或“<”) ,理由是____________________。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl
NHCl2(l)+2HCl(g),测得平衡时Cl

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)