题目内容
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ____。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn__________g。(已经F=96500C/mol)
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为___________时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是_________。
【答案】MnO2+e-+H+=MnOOH 0.05 2.7 6 Zn2+和Fe2+分离不开
【解析】
(1)该电池负极锌被氧化生成Zn2+,正极发生还原反应,MnO2被还原生成MnOOH;
(2)持电流强度为0.5A,电池工作五分钟,则电量为0.5A×300s=150C,转移电子的物质的量为150C÷96500C·mol-1,以此计算消耗锌的质量、物质的量;
(3)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol·L-1,结合Ksp=10-39计算pH,并根据Ksp计算锌开始沉淀的pH.
Zn(OH)2和 Fe(OH)2的Ksp相近,同时沉淀。
(1)该电池负极锌被氧化生成Zn2+,正极发生还原反应,MnO2被还原生成MnOOH,电极方程式为MnO2+H++e-=MnOOH;
(2)持电流强度为0.5A,电池工作五分钟,则电量为0.5A×300s=150C,转移电子的物质的量为150C÷96500C·mol-1,则消耗Zn的质量为![]() ×65g·mol-1=0.05g;
×65g·mol-1=0.05g;
(3)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol·L-1,因Ksp=10-39,则c(OH-)=![]() mol·L-1≈0.5×10-11mol·L-1,此时pH=2.7;如锌开始沉淀,则c(OH-)=
mol·L-1≈0.5×10-11mol·L-1,此时pH=2.7;如锌开始沉淀,则c(OH-)=![]() mol·L-1=10-8mol·L-1,此时pH=6;若上述过程不加H2O2后果是:Zn(OH)2和 Fe(OH)2的Ksp相近,同时沉淀,Zn2+和Fe2+分离不开。
mol·L-1=10-8mol·L-1,此时pH=6;若上述过程不加H2O2后果是:Zn(OH)2和 Fe(OH)2的Ksp相近,同时沉淀,Zn2+和Fe2+分离不开。

 阅读快车系列答案
阅读快车系列答案【题目】已知0.1mol/LH2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式___。
(2)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为___。
(3)根据题设条件计算CH3COOH的电离常数Ka=___。若常温下,将bmol·L–1的CH3COONa液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=___。
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
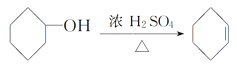 +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度/ g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
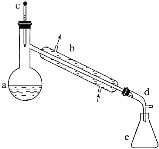
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并______;在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
【题目】已知反应![]() ,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,![]()
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ