题目内容
【题目】某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转。
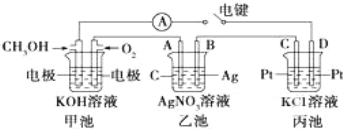
请回答下列问题:
(1)通入 CH3OH 电极的电极反应:___________________。
(2)乙池中 A(石墨)电极的名称为_________________(填“正极”、“负极”或“阴极”、“阳极”),总化学反应式为___________________。
(3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为_______mL(标准状况)。若丙池中KCl溶液的体积是500mL,电解后,溶液的pH为_________(设电解前后溶液体积无变化)。
【答案】CH3OH-6e-+8OH-=CO32-+6H2O 阳极 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280 13
4Ag+O2↑+4HNO3 280 13
【解析】
(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,结合电荷守恒写出电极反应;
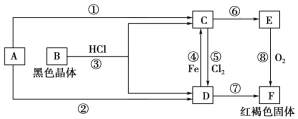
(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气;
(3)乙池是电解池结合电子守恒计算消耗氧气的体积,丙为电解池C为阳极,D为阴极,电解氯化钾溶液,生成氢氧化钾、氢气和氯气;
(1)甲池为原电池,燃料在负极失电子发生氧化还原反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)乙池是电解池,A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气,电池反应为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 ;
4Ag+O2↑+4HNO3 ;
(3)当乙池中B极质量增加5.4g为Ag,物质的量=5.4g÷108g·mol-1=0.05mol,依据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的体积=![]() mol×22.4L·mol-1=0.28L=280mL;丙为电解池C为阳极,D为阴极,电解氯化钾溶液,生成氢氧化钾、氢气和氯气,结合电子守恒计算KOH~e-,n(KOH)=0.05mol,c(KOH)=0.05mol÷0.5L=0.1mol·L-1,pH= -lg
mol×22.4L·mol-1=0.28L=280mL;丙为电解池C为阳极,D为阴极,电解氯化钾溶液,生成氢氧化钾、氢气和氯气,结合电子守恒计算KOH~e-,n(KOH)=0.05mol,c(KOH)=0.05mol÷0.5L=0.1mol·L-1,pH= -lg![]() =13。
=13。

 发散思维新课堂系列答案
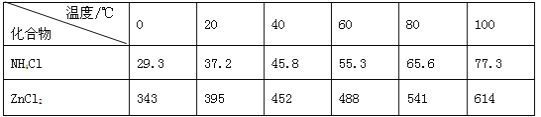
发散思维新课堂系列答案【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ____。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn__________g。(已经F=96500C/mol)
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为___________时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是_________。
【题目】S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)![]() S2Cl2(g) △H1=xkJ/mol
S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)![]() 2SCl2(g) △H2=ykJ/mol
2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键 | S-S | S-Cl | Cl-Cl |
键能/kJ/mol | a | b | c |
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为: ![]()
C. y=2b-a-c D. 在S2(1)+2Cl2(g)![]() 2SCl2(g)的反应中,△H=(x+y)kJ/mol
2SCl2(g)的反应中,△H=(x+y)kJ/mol