题目内容
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE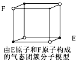
【答案】B
【解析】
A. 价电子排布为ns1的元素,为第IA族元素,一定为s区元素,故A错误;
B. Fe是26元素,其价电子数是8,每个配体CO分子提供电子数为2,则8+2n=18,解得n=5,故B正确;
C. 甲醛分子中碳原子形成了3个σ键,没有孤电子对,因此,碳原子采取sp2杂化,甲醛分子的立体构型为平面三角形,光卤气(COCl2)分子中C原子价层电子对数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面三角形,但是甲醛中与C原子连接的为2个H和1个O,光卤气中与C原子连接的为2个Cl和1个O,H和Cl的电负性不同,则键角不相同,故C错误;
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面三角形,但是甲醛中与C原子连接的为2个H和1个O,光卤气中与C原子连接的为2个Cl和1个O,H和Cl的电负性不同,则键角不相同,故C错误;
D. 团簇分子中含有4个E,4个F原子,分子式应为E4F4或F4E4,故D错误;
答案选B。

【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角锥形 | 三角锥形 |
D | CH4 | sp3 | 正四面体形 | 正四面体形 |
A.AB.BC.CD.D
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
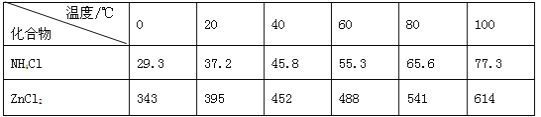
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ____。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn__________g。(已经F=96500C/mol)
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为___________时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是_________。