��Ŀ����
����Ŀ����ͼ��ʾ��U�ι���ʢ��100mL����Һ����Ҫ��ش��������⣺ 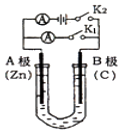
��1����K2 �� �պ�K1 �� ����ʢ��ҺΪCuSO4��Һ����AΪ����B���ĵ缫��ӦʽΪ �� ����ʢ��ҺΪKCl��Һ����B���ĵ缫��ӦʽΪ �� K+����������A��B��
��2����K1 �� �պ�K2 �� ����ʢ��ҺΪ���з�̪��NaCl��Һ���� ��A�缫�����ɹ۲쵽�������� �� �ܷ�Ӧ��ѧ����ʽ�� ��
�ڷ�Ӧһ��ʱ����K2 �� ��������Һ������仯��������ܽ⣬B������������������״����Ϊ11.2mL������Һ��ֻ�ϣ���Һ��pHԼΪ �� ��Ҫʹ�������Һ�ָ���ԭ״̬������U�ι��ڼ����ͨ��һ������ ��
��3����Ҫ�õ�ⷽ��������ͭ����K1 �� �պ�K2 �� ���Һѡ��CuSO4��Һ����A�缫�IJ���Ӧ������ �� ��Ӧһ��ʱ���������Һ��Cu2+Ũ�������������С���������䡱����
���𰸡�
��1������Cu2++2e���TCu��O2+2H2O+4e��=4OH����B
��2��������ɫ���ݣ���Һ���ɫ��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����12��HCl
2NaOH+H2��+Cl2����12��HCl
��3����ͭ����С
���������⣺��1����K2 �� �պ�K1 �� ��װ��Ϊԭ��أ�A����Zn��ʧ������������B����C��������B�缫��ͭ���ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪCu2++2e���TCu������ʢ��ҺΪKCl��Һ��B�缫�������õ��ӷ�����ԭ��Ӧ���缫������ΪO2+2H2O+4e��=4OH�����������Һ�����������ƶ����������������ƶ������Լ�����������B�ƶ��� ���Դ��ǣ�����Cu2++2e���TCu��O2+2H2O+4e��=4OH����B����2����K1 �� �պ�K2 �� ��װ���ǵ��أ�AΪ������BΪ������
����ʢ��ҺΪ���з�̪��NaCl��Һ��
��A�缫��ˮ�õ�������������ͬʱ��Һ�л�����OH�� �� ����A��������Һ������ǿ����Һ���ɫ������A�缫�Ͽ����������Dz�����ɫ���ݣ���Һ���ɫ��
B�缫�������ӷŵ�������������ط�ӦʽΪ2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
���Դ��ǣ�������ɫ���ݣ���Һ���ɫ��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
�ڷ�Ӧһ��ʱ����K2 �� ��������Һ������仯��������ܽ⣬B������������������״����Ϊ11.2mL������2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����c��NaOH��=
2NaOH+H2��+Cl2����c��NaOH��= ![]() =0.01mol/L������Һ��pH=12��
=0.01mol/L������Һ��pH=12��
���������������������������������������������൱������HCl����Ҫʹ�������Һ�ָ���ԭ״̬�����ݡ�����ʲô����ʲô��ԭ���������Ӧ����HCl��
���Դ��ǣ�12��HCl����3����Ҫ�õ�ⷽ��������ͭ����K1 �� �պ�K2 �� ���Һѡ��CuSO4��Һ����ͭ����������ͭ������������AӦ���Ǵ�ͭ��BΪ��ͭ���ܽ��CuС��������Cu��������Һ��ͭ����Ũ�ȼ�С��
���Դ��ǣ���ͭ����С��

 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�����Ŀ����ش��������⣮
��1��ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ100��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ� 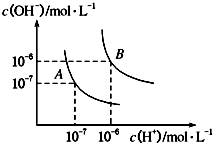
��100��ʱ1molL��1��NaOH��Һ�У���ˮ�������c��H+��=molL��1 �� KW��25�棩KW��100�棩�����������������=������
��25��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4Cl���壬��ˮ�ĵ���ƽ���Ӱ��������ٽ����������ơ���Ӱ�족����
��2������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݣ�
��ѧʽ | ����ƽ�ⳣ����25�棩 |
HCN | K=4.9��10��10 |
CH3COOH | K=1.8��10��5 |
H2CO3 | K1=4.3��10��7��K2=5.6��10��11 |
��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ b��CH3COONa ��Һ c��Na2CO3��Һ��������Һ��pH�ɴ�С��˳��Ϊ��������ţ�
��25��ʱ����Ũ�ȵ�CH3COOH��Һ��NaOH��Һ�������ϣ���c��Na+��c��CH3COO���������������������=������
����Ŀ���ߴ����������Ϣ�����Ĺؼ����ϡ�
��1����Ԫ��λ�����ڱ���__________����_________�塣�����йع���ϵ�˵������ȷ����________(����ĸ)��
A.̼���軯ѧ�����ȶ�����������������ˮ��
B.������Ӳ�ȴ��۵�ߣ����������������մɺ����
C.�ߴ��ȵĶ���������������������ͨѶ���Ϲ��ά
D.��ͨ�������ɴ��ʯ��ʯ��ʯӢɰ�Ƴɵģ����ڲ�����ڵ�ȼH2ʱ���ֻ�ɫ����
E. ���������跴Ӧ���ʲ�������Ϊ��Һ�ⵥ����
��2����ҵ����ʯӢɰ�ͽ�̿���Ƶôֹ衣
��֪��

�뽫���·�Ӧ���Ȼ�ѧ����ʽ����������SiO2(s)+2C(s)�TSi(s)+2CO(g) ��H=_____________
��3���ֹ辭ϵ�з�Ӧ�����ɹ���(SiH4)������ֽ����ɸߴ��裮��֪����ķֽ��¶�Զ���ڼ��飬��ԭ�ӽṹ������ԭ��________________________________��SiԪ�صķǽ���������CԪ�أ���������ȶ������ڼ��顣
��4�����ֹ�ת�����������(SiHCl3)����һ����ӦҲ���Ƶøߴ��衣
��SiHCl3�к��е�SiCl4��AsCl3�����ʶԾ�����������Ӱ�죮�����±����ݣ�����_________________�����ᴿSiHCl3��
���� | SiHCl3 | SiCl4 | AsCl3 |
�е�/�� | 32.0 | 57.5 | 131.6 |
����SiHCl3�Ʊ��ߴ���ķ�ӦΪSiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ������Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����_____________________������ĸ��ţ���
Si(s)+3HCl(g)����ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ������Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����_____________________������ĸ��ţ���
a.�÷�Ӧ��ƽ�ⳣ�����¶����߶�����
b.�������ʾ��Ͷ�ϱ�Ӧ����![]()
C.ʵ��������Ϊ���SiHCl3�������ʣ�Ӧ�ʵ������¶�
�������Ʊ����̱����ϸ������ˮ������SiHCl3��ˮ���ҷ�Ӧ����H2SiO3��HC1����һ�����ʣ�д����ƽ�Ļ�ѧ��Ӧ����ʽ��____________________________________��
