题目内容
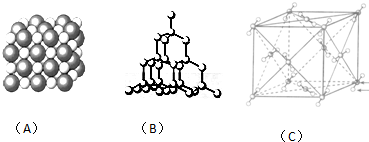
19.关于如图图示的说法中正确的是( )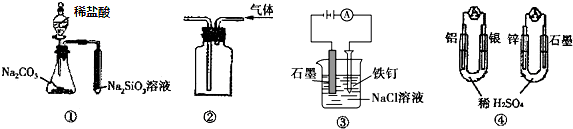
| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集CH4气体 | |
| C. | 装置③可电解食盐水制氯气 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
分析 A.稀盐酸易挥发,盐酸可与硅酸钠溶液反应;
B.甲烷的密度比空气小,选择向下排空气法收集;
C.Fe与电源正极相连,为阳极,失去电子;
D.负极分别为Al、Zn,存在2Al~6e-~3Zn.
解答 解:A.稀盐酸易挥发,盐酸可与硅酸钠溶液反应,则图中装置不能比较碳酸与硅酸的酸性,则不能C、Si的非金属性,故A错误;
B.甲烷的密度比空气小,选择向下排空气法收集,则图中短导管进入可收集CH4气体,故B正确;
C.Fe与电源正极相连,为阳极,失去电子,则阳极上氯离子不能得到电子生成氯气,故C错误;
D.负极分别为Al、Zn,存在2Al~6e-~3Zn,可知转移电子相同时,消耗负极材料的物质的量不同,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性与非金属性的比较、气体的收集、电化学原理及应用等,把握物质的性质、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.随着原子序数的递增,元素周期表第三周期元素(Ar除外)的性质变化规律正确的是( )
| A. | 金属性保持不变 | B. | 非金属性逐渐增强 | ||
| C. | 金属性逐渐增强 | D. | 非金属性保持不变 |
7.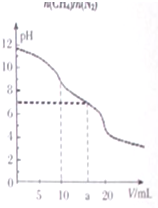 常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
 常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-) | |
| B. | 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
14.某有机物A的结构简式如图所示:下列叙述正确的是( )


| A. | 1molA最多可与4molBr2发生反应 | |
| B. | A分子中含有三类官能团 | |
| C. | 1molA与足量的NaOH反应,最多可以消耗3molNaOH | |
| D. | A的分子式为C13H15O4Cl |
4.能形成A2B型离子化合物的两种元素的原子序数是( )
| A. | 20和8 | B. | 1和6 | C. | 11和16 | D. | 12和17 |
11.乙醇分子中各化学键如右图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )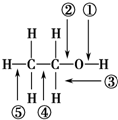

| A. | 和金属钠作用时,键①断裂 | |
| B. | 在铜催化下和氧气反应时,键①和③断裂 | |
| C. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| D. | 和乙酸、浓硫酸共热时,键②断裂 |
8.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 欲除去混在苯中的少量苯酚,可加入过量溴水,过滤 | |
| C. | 乙烷和丙烯的物质的量各1mol,完全燃烧各生成3molH2O | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
9.有机物分子中原子之间(或原子与原子团之间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 乙醇不能与NaOH溶液反应,苯酚则能跟NaOH溶液反应 | |
| B. | 乙醛一定条件下能与氢气发生加成反应,乙酸一般不能与氢气发生加成反应 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,甲苯则能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |