题目内容
10.如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分.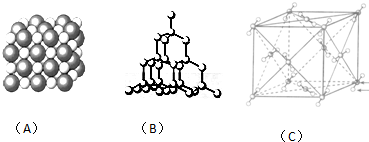
(1)其中代表金刚石的是(填编号字母,下同)B,金刚石属于原子晶体.
(2)其中代表NaCl的是A,晶体中Na+与Cl-之间通过离子键结合起来.
(3)代表干冰的是C,它属于分子晶体,CO2分子间通过分子间作用力结合起来.
(4)上述物质中熔点由高到低的排列顺序为金刚石>氯化钠>干冰.
分析 (1)金刚石属于原子晶体,为空间网状结构;
(2)NaCl中钠离子与氯离子通过离子键结合,氯离子半径大于钠离子半径;
(3)二氧化碳晶体属于分子晶体,分子间通过分子间作用力结合;
(4)熔点的一般规律:原子晶体>离子晶体>分子晶体.
解答 解:(1)金刚石晶体中碳原子间以共价键结合形成空间网状结构属于原子晶体,图中属于金刚石的结构图为B;
故答案为:B;原子;
(2)NaCl中钠离子与氯离子通过离子键结合,氯离子半径大于钠离子半径,则晶胞图A为氯化钠;
故答案为:A;离子;
(3)二氧化碳晶体属于分子晶体,分子间通过分子间作用力结合,图中C属于二氧化碳晶体的晶胞图;
故答案为:C;分子;分子间作用力;
(4)熔点的一般规律:原子晶体>离子晶体>分子晶体,则熔点:金刚石>氯化钠>干冰;
故答案为:金刚石>氯化钠>干冰.
点评 本题考查了常见晶体的晶胞图、不同晶体的熔点比较,题目难度不大,注意把握不同晶体中微粒之间的作用力以及晶体熔沸点的比较方法.

练习册系列答案
相关题目
18.下列离子方程式书写正确的是( )
| A. | 氢氧化钠溶液和稀盐酸反应:H++OH-═H2O | |
| B. | 大理石与盐酸反应制取二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁粉投入FeCl3溶液中:Fe+Fe3+═2Fe2+ | |
| D. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
15.反应C(s)+H2O(g)?CO(g)+H2(g)在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加C的量 | B. | 将容器的体积缩小一半 | ||
| C. | 保持容器体积不变,充入N2 | D. | 保持容器体积不变,充入H2O(g) |
2.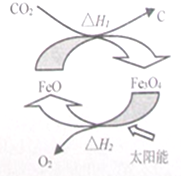 太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
 太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )| A. | 分解1molFe3O4转移电子数为2NA | |
| B. | 根据盖斯定律可知,△H1+△H2=0 | |
| C. | FeO在CO2转化为C的过程中的作用是催化剂 | |
| D. | CO2中σ键与π键个数之比为1:2 |
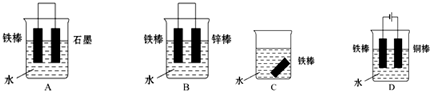
19.关于如图图示的说法中正确的是( )
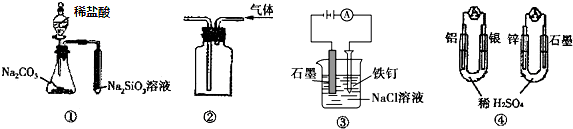

| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集CH4气体 | |
| C. | 装置③可电解食盐水制氯气 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
20.甲容器中进行如下反应4A(s)+3B(g)?2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的下列说法正确的是( )
| A. | 在2 min末的反应速率,用B表示是 0.3 mol/(L•min) | |
| B. | 用A表示的反应速率是0.4 mol/(L•min) | |
| C. | 若乙容器中也同时进行此反应,且相同时间段内用D表示的速率是0.2 mol/(L•min),则乙容器中反应速率更快 | |
| D. | 对甲容器升高温度,则正反应速率将减小 |
 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题: