题目内容
11.乙醇分子中各化学键如右图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )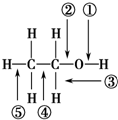
| A. | 和金属钠作用时,键①断裂 | |
| B. | 在铜催化下和氧气反应时,键①和③断裂 | |
| C. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| D. | 和乙酸、浓硫酸共热时,键②断裂 |
分析 A.与Na反应生成氢气,O-H键断裂;
B.在Cu催化下与O2反应时,生成醛,C-H、O-H键断裂;
C.共热至170℃时生成乙烯,C-O和C-H键断裂;
D.与乙酸反应生成乙酸乙酯,羧酸断开羟基,醇断H,据此解答即可.
解答 解:A.与Na反应生成氢气,O-H键断裂,即①断裂,故A正确;
B.在铜催化下与O2反应时,生成醛,C-H、O-H键断裂,则键①、③断裂,故B正确;
C.共热至170℃时生成乙烯,C-O和C-H键断裂,键②、⑤键断裂,故C正确;
D.与乙酸反应生成乙酸乙酯,羧酸断开羟基,醇断H,即断开①,故D错误,
故选D.
点评 本题考查有机物的结构与性质,侧重乙醇性质的考查,注意乙醇的性质与官能团、化学键的关系,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
2.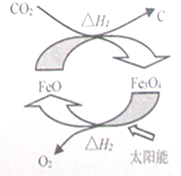 太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
 太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )
太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是(NA为阿伏伽德罗常数的值)( )| A. | 分解1molFe3O4转移电子数为2NA | |
| B. | 根据盖斯定律可知,△H1+△H2=0 | |
| C. | FeO在CO2转化为C的过程中的作用是催化剂 | |
| D. | CO2中σ键与π键个数之比为1:2 |
19.关于如图图示的说法中正确的是( )
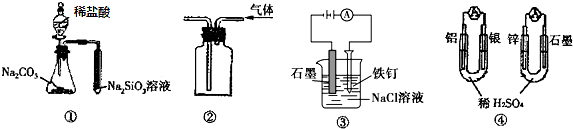

| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集CH4气体 | |
| C. | 装置③可电解食盐水制氯气 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
3.下列实验能够成功的是( )
| A. | 利用苯和溴水在铁作催化剂的条件下制备溴苯 | |
| B. | 向淀粉在酸性条件下水解的产物中加银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 在溴乙烷与NaOH溶液反应后的溶液中直接滴加硝酸银溶液来检验卤素的种类 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热,产生砖红色沉淀 |
20.甲容器中进行如下反应4A(s)+3B(g)?2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的下列说法正确的是( )
| A. | 在2 min末的反应速率,用B表示是 0.3 mol/(L•min) | |
| B. | 用A表示的反应速率是0.4 mol/(L•min) | |
| C. | 若乙容器中也同时进行此反应,且相同时间段内用D表示的速率是0.2 mol/(L•min),则乙容器中反应速率更快 | |
| D. | 对甲容器升高温度,则正反应速率将减小 |
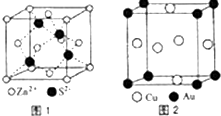 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题: 我国国家标准( GB2760 )规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
我国国家标准( GB2760 )规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.