题目内容
9.随着原子序数的递增,元素周期表第三周期元素(Ar除外)的性质变化规律正确的是( )| A. | 金属性保持不变 | B. | 非金属性逐渐增强 | ||
| C. | 金属性逐渐增强 | D. | 非金属性保持不变 |
分析 第三周期元素,随着原子序数增大,原子最外层电子数逐渐增多,原子得电子能力逐渐增强,失电子能力逐渐减弱,得电子能力越强其非金属性越强,失电子能力越强,其金属性越强,据此分析解答.
解答 解:元素得电子能力越强其非金属性越强,失电子能力越强,其金属性越强,第三周期元素,随着原子序数增大,原子最外层电子数逐渐增多,原子得电子能力逐渐增强,失电子能力逐渐减弱,所以其金属性逐渐减弱、非金属性逐渐增强,故选B.
点评 本题考查同一周期元素性质递变规律,明确原子得失电子强弱与金属性、非金属性强弱关系即可解答,熟悉元素周期律内涵并灵活运用,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
6.下列说法正确的是( )
| A. | 烟、云、雾不属于胶体分散系 | |
| B. | 胶体和溶液可以用萃取的方法进行分离 | |
| C. | 用过滤的方法可以将NaCl从Fe(OH)3胶体和NaCl混和物中分离出来 | |
| D. | 用丁达尔效应可以区分胶体和溶液 |
14.下列指定微粒的个数比为2:1的是( )
| A. | 2H原子中的中子和质子 | |
| B. | Be2+离子中的质子和电子 | |
| C. | NaHCO3晶体中的阳离子和阴离子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
18.下列离子方程式书写正确的是( )
| A. | 氢氧化钠溶液和稀盐酸反应:H++OH-═H2O | |
| B. | 大理石与盐酸反应制取二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁粉投入FeCl3溶液中:Fe+Fe3+═2Fe2+ | |
| D. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
19.关于如图图示的说法中正确的是( )
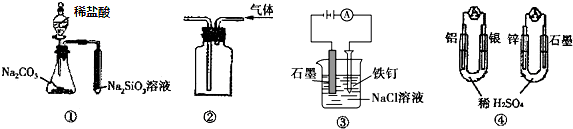

| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集CH4气体 | |
| C. | 装置③可电解食盐水制氯气 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
 和
和
 和
和
 和
和
 .
.
 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、CuCu5Zn8等.回答下列问题: