题目内容
【题目】已知:A、B、C均是由短周期元素组成的单质,其余物质均为化合物.F在常温常压下为液态,I为具有磁性的黑色晶体.它们有下图所示的转化关系: 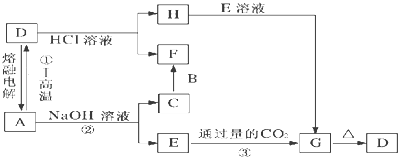
根据以上转换关系回答:
(1)写出反应①的化学方程式:;
(2)写出反应②的离子方程式:;写出H+E反应的离子方程式:;
(3)将I溶于足量盐酸,请分别写出反应后混合溶液中存在的阳离子、检验所需试剂及相应现象(可不填满):
阳离子 | 检验试剂 |
【答案】
(1)8Al+3Fe3O4 ![]() 9Fe+4Al2O3
9Fe+4Al2O3
(2)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Al3++3AlO2﹣+6H2O═4Al(OH)3↓
(3)H+;石蕊试液;Fe3+;KSCN溶液;Fe2+;K3[Fe(CN)6]
【解析】解:A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,由D与盐酸反应得到,可以推断F为H2O,I为具有磁性的黑色晶体,为Fe3O4 , 由A与D相互转化及D能与氢氧化钠溶液反应,可知A为Al、D为Al2O3 , 结合转化关系,可推知C为H2、E为NaAlO2、G为Al(OH)3、B为O2、H为AlCl3 , (1)反应①的化学方程式为:8Al+3Fe3O4 ![]() 9Fe+4Al2O3 , 所以答案是:8Al+3Fe3O4
9Fe+4Al2O3 , 所以答案是:8Al+3Fe3O4 ![]() 9Fe+4Al2O3;(2)反应②的离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;H为AlCl3 , E为NaAlO2 , H+E反应的离子方程式为:Al3++3AlO2﹣+6H2O═4Al(OH)3↓,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Al3++3AlO2﹣+6H2O═4Al(OH)3↓;(3)将Fe3O4溶于足量盐酸生成氯化铁、氯化亚铁,所以溶液中存在的阳离子为H+、Fe3+、Fe2+、检验H+用石蕊试液,现象为溶液呈红色,检验Fe3+用KSCN溶液,现象为溶液出现血红色,检验Fe2+用K3[Fe(CN)6],现象为蓝色沉淀, 所以答案是:
9Fe+4Al2O3;(2)反应②的离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;H为AlCl3 , E为NaAlO2 , H+E反应的离子方程式为:Al3++3AlO2﹣+6H2O═4Al(OH)3↓,所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Al3++3AlO2﹣+6H2O═4Al(OH)3↓;(3)将Fe3O4溶于足量盐酸生成氯化铁、氯化亚铁,所以溶液中存在的阳离子为H+、Fe3+、Fe2+、检验H+用石蕊试液,现象为溶液呈红色,检验Fe3+用KSCN溶液,现象为溶液出现血红色,检验Fe2+用K3[Fe(CN)6],现象为蓝色沉淀, 所以答案是:
阳离子 | 检验试剂 |
H+ | 石蕊试液等 |
Fe3+ | KSCN溶液等 |
Fe2+ | K3[Fe(CN)6] |
;