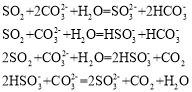题目内容
【题目】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。

(1)田老师利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
Ⅰ.分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用。
Ⅱ.用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
Ⅲ.由计算机绘制的滴定曲线如图一:
①A是_____;
②两曲线图中V1_____V2 (填“>”、“=”或“<”),A点和B点,水的电离程度相比_________(填“A大”、“B大”、“一样大”或“无法判断”)。
(2)程老师利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:用_____(填仪器名称)量取20.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_____(填“是”、“否”或“不能确定”),向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见图二)。
①图中b点时,![]() _______mol/L
_______mol/L
②若图中某一点pH等于8,则c(Na+)﹣c(CH3COO﹣)的精确值为_____ mol/L。
【答案】盐酸 > 一样大 酸式滴定管 否 0.05 9.9×10﹣7
【解析】
①根据图像得出开始为滴定时,A图pH值等于1。
②用假设法分析,假设等于10mL,溶液显酸碱性来分析,A点溶质为NaCl,不水解,B点溶质为醋酸和醋酸钠,呈中性说明醋酸抑制水的电离的程度与醋酸钠促进水的电离的程度相当。
⑵醋酸显酸性,根据量取20.00mL选用仪器,锥形瓶中含有少量蒸馏水,溶质物质的量未变;①根据图中b点,得出醋酸和氢氧化钠两者恰好完全应完,则消耗10mL氢氧化钠,混合后溶液的体积为20mL,溶质为醋酸钠,根据物料守恒和溶液体积变为二倍分析得出;②若图中某一点pH等于8,根据电荷守恒变形得到计算值。
①根据图像得出开始为滴定时,A图pH值等于1,说明是盐酸,故答案为:盐酸。
②pH =7,则盐酸消耗得氢氧化钠体积为10mL,而如果加入10mL到醋酸中,则恰好反应生成醋酸钠,溶液显碱性,而这需要呈中性,说明碱滴加过量,因此体积要小于10mL,即两曲线图中V1>V2,A点溶质为NaCl,强酸强碱盐,不水解,B点溶质为醋酸和醋酸钠,醋酸抑制水的电离,醋酸钠促进水的电离,而溶液呈中性,醋酸抑制水的电离程度和醋酸钠促进水的电离程度相等,两者抵消,因此对水的电离无影响,因此水的电离程度相比一样大;故答案为:>;一样大。
⑵醋酸显酸性,量取20.00mL,从数据看只能用酸式滴定管量取醋酸溶液样品,倒入洁净干燥锥形瓶中,如果锥形瓶中含有少量蒸馏水,溶质物质的量不变,因此不会影响测量结果,故答案为:酸式滴定管;否。
①根据图中b点,得出醋酸和氢氧化钠两者恰好完全应完,则消耗10mL氢氧化钠,混合后溶液的体积为20mL,溶质为醋酸钠,根据物料守恒得到![]() c(Na+) =
c(Na+) = ![]() ;故答案为:0.05。
;故答案为:0.05。
②若图中某一点pH等于8,根据电荷守恒变形得到c(Na+)c(CH3COO-)= c(OH-)c(H+)=1×106 mol·L11×108 mol·L1=9.9×107 mol·L1;故答案为:9.9×107。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案