题目内容
4.常温下,有关物质的溶度积如表所示.| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
| A. | 常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好 | |
| B. | 常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好 | |
| C. | 向含有Mg2+,Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021 | |
| D. | 无法利用Ca(OH)2制备NaOH |
分析 A、MgCO3是微溶物,其溶度积远远大于Mg(OH)2;
B、Ca(OH)2是微溶物,其溶度积远远大于CaCO3;
C、根据氢氧化镁和氢氧化铁的溶解平衡以及溶度积表达式计算;
D、Ca(OH)2与碳酸钠溶液反应能够生成NaOH.
解答 解:A、因为MgCO3是微溶物,其溶度积远远大于Mg(OH)2,所以除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好,故A正确;
B、因为Ca(OH)2是微溶物,其溶度积远远大于CaCO3,所以除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好,故B正确;
C、则当两种沉淀共存且溶液的pH=8时,c(Mg2+)=$\frac{{K}_{sp}}{[O{H}^{-}]^{2}}$=$\frac{5.61×1{0}^{-12}}{1{0}^{-12}}$=5.61mol/L,c(Fe3+)=$\frac{{K}_{sp}}{[O{H}^{-}]^{3}}$=$\frac{2.64×1{0}^{-39}}{1{0}^{-18}}$=2.64×10-21mol/L,所以 c(Mg2+):c(Fe3+)=5.61:2.64×10-21=2.125×1021,故C正确;
D、Ca(OH)2与碳酸钠溶液反应能够生成NaOH和碳酸钙沉淀,故D错误;
故选D.
点评 本题考查了有关溶度积的计算以及据溶度积的大小判断沉淀的转化,题目难度不大.

练习册系列答案
相关题目
9.下列物质分类正确的是( )
| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 是否具有丁达尔效应是胶体与溶液、浊液的根本区别 | |
| C. | 纯净盐酸为纯净物、冰水混合物为混合物 | |
| D. | 烧碱、纯碱都属于碱,油脂、甘油都属于酯 |
16.下列说法不正确的是( )
| A. | SO${\;}_{4}^{2-}$的摩尔质量是96g/mol | |
| B. | 1molH2中含有2molH | |
| C. | 1molH2O的质量等于NA个H2O质量的总和 | |
| D. | 1molO2的质量为32g/mol |
7.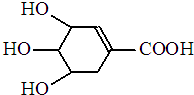 八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
 八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )| A. | 能溶于水 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生酯化反应 | D. | 遇FeCl3溶液呈紫色 |
 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
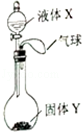 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( ) +2C2H5OH
+2C2H5OH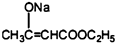 +CH3COOH→
+CH3COOH→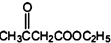 +CH3COONa
+CH3COONa