题目内容
15.下列与金属腐蚀有关的说法,正确的是( )| A. | 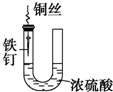 铁钉易被腐蚀 | |
| B. | 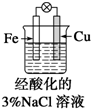 滴加少量KSCN溶液,溶液变为血红色 | |
| C. |  燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. |  用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
分析 A、铁钉与溶液不接触不能形成原电池,据此回答;
B、原电池铁是负极,失去电子转化为亚铁离子,遇到KSCN溶液不显色;
C、主要是由于高温下铁发生化学腐蚀;
D、原电池的负极金属易生锈,可以采用牺牲阳极阴极保护法来保护金属.
解答 解:A、铁钉与溶液不接触不能形成原电池,因此不易被腐蚀,故A错误;
B、图2中构成原电池铁是负极失去电子转化为亚铁离子,因此滴加少量KSCN溶液,溶液不会为血红色,故B错误;C、燃气灶的中心部位温度较高,和氧气接触的铁,在高温下会发生化学反应而容易生锈,即高温下铁发生化学腐蚀,故C正确;
D、用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极,故D错误.
故选C.
点评 本题综合考查电化学知识,侧重于金属的腐蚀与防护以及原电池的工作原理的考查,题目难度不大,注意所学知识的迁移应用.

练习册系列答案
相关题目
10. 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-246.4 kJ•mol-1.
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是bce.
a.高温低压 b.低温高压
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)=0.04 mol•L-1.
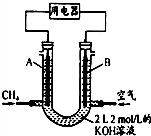
(5)将CH4设计成燃料电池,其装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O;
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-;
③V=67.2L时,溶液中阴离子浓度大小关系为c(HCO3-)>c(CO32-)>c(OH-).
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-246.4 kJ•mol-1.
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是bce.
a.高温低压 b.低温高压
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(5)将CH4设计成燃料电池,其装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O;
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-;
③V=67.2L时,溶液中阴离子浓度大小关系为c(HCO3-)>c(CO32-)>c(OH-).
20.某主族元素的最高价氧化物的水化物的化学式是HRO3,则该元素的气态氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH4 | D. | RH3 |
7.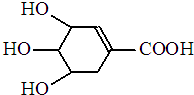 八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
 八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )
八角茴香含有一种抗亚洲禽流感病毒的重要成分-莽草酸,其分子结构如图所示.下列关于莽草酸的说法错误的是( )| A. | 能溶于水 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生酯化反应 | D. | 遇FeCl3溶液呈紫色 |

 +2C2H5OH
+2C2H5OH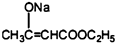 +CH3COOH→
+CH3COOH→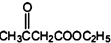 +CH3COONa
+CH3COONa
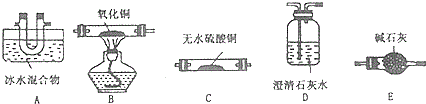
 某同学以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸并探究测定草酸晶体(H2C2O4•xH2O)的某些性质.通过查阅资料可知:草酸易溶于水,是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.
某同学以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸并探究测定草酸晶体(H2C2O4•xH2O)的某些性质.通过查阅资料可知:草酸易溶于水,是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.
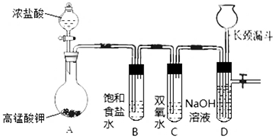 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题:
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题: HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.
HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.