题目内容
13.浙江大学成功研制出能在数分钟之内将电量充满的锂电池,其成本只有传统锂电池的一半.若电解液为LiAlCl4-SOCl2,电池的总反应为:4Li+2SOCl2$?_{充电}^{放电}$4LiCl+S+SO2.下列说法不正确的是( )| A. | Li为电池的负极 | |
| B. | 电池的电解液可用LiCl水溶液代替 | |
| C. | 放电时电子从负极经外电路流向正极 | |
| D. | 充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
分析 A.放电时,失电子化合价升高的电极是负极;
B.水和Li发生反应生成LiOH和氢气;
C.放电时,电子从负极沿导线流向正极;
D.充电时,阳极上S失电子发生氧化反应.
解答 解:A.放电时,失电子化合价升高的电极是负极,根据电池反应式知,放电时Li元素化合价由0价变为+1价,所以Li是负极,故A正确;
B.Li是一种碱金属,比较活泼,能与H2O直接发生反应,因此该锂电池的电解液不能用LiCl水溶液代替LiAlCl4-SOCl2,故B错误;
C.放电时,Li是负极,另一个电极是正极,负极上失电子、正极上得电子,所以电子从负极沿导线流向正极,故C正确;
D.充电时,阳极上S失电子发生氧化反应,阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2,故D正确;
故选B.
点评 本题考查化学电源新型电池,明确原电池、电解池判断方法是解本题关键,难点是电极反应式的书写,要结合电池反应式及元素化合价变化书写,易错选项是B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列物质见光不会分解的是( )
| A. | HClO | B. | NH4Cl | C. | HNO3 | D. | AgNO3 |
4.下列化学实验中的第一步操作错误的是( )
| A. | 检查装置的气密性--制取气体、验证气体的性质等与气体有关的实验操作 | |
| B. | 检查是否漏水--滴定管、容量瓶、分液漏斗等的使用 | |
| C. | 验纯--点燃可燃性气体 | |
| D. | 湿润--用石蕊试纸、碘化钾淀粉试纸和pH 试纸检验或验证某些气体 |
1.下列有关物质分类正确的是( )
| A. | 液氯、干冰均为纯净物 | |
| B. | NO2、CO、CO2均为酸性氧化物 | |
| C. |  与 与 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和油脂都属于天然高分子化合物 |
8. 把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
 把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )| A. | Ⅰ和Ⅲ附近 | B. | Ⅰ和Ⅳ附近 | C. | Ⅱ和Ⅲ附近 | D. | Ⅱ和Ⅳ附近 |
18.下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是( )
| A. | 属于羧基类的有2种 | |
| B. | 属于酯类的有3种 | |
| C. | 存在分子中含有六元环的同分异构体 | |
| D. | 分子中可含有两种不同的官能团 |
3.下列说法不正确的是( )
| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a |
20.下列叙述中正确的是( )
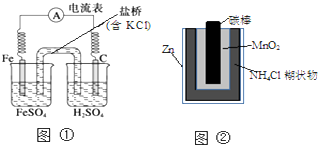

| A. | 图①中正极附近溶液pH降低 | |
| B. | 图②正极反应是2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) | |
| C. | 图①中电子由Fe流向石墨,盐桥中的Cl-移向FeSO4溶液 | |
| D. | Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
20.将a g二氧化锰粉末加入cL b mol•L-1的浓盐酸中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | B. | 反应后Cl-数目为bc-d | ||
| C. | NA可表示为$\frac{87d}{2a}$ | D. | 反应后溶液中的H+数目为bc-2d |