题目内容
【题目】常温下,向20mL 0.1 mol·L-1CH3COOH溶液中滴加0.1mol·L-1的NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
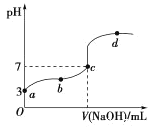
A.c点对应的V(NaOH)<20mL
B.a点表示的溶液中由水电离出的H+浓度为1.0![]() 10-11mol·L-1
10-11mol·L-1
C.b点表示的溶液中 c(CH3COO -)>c(Na+)
D.b、d点表示的溶液中c(CH3COO-)与c(CH3COOH)的比值相等
【答案】D
【解析】
A. b点时,pH=7,则c(H+)=c(OH-),根据电荷守恒有c(CH3COO-)=c(Na+),CH3COOH部分电离,因此V(NaOH溶液)<20 mL,故A正确;
B. a点溶液呈酸性,溶液pH=3,溶液中OH离子源于水的电离,由水电离出的H+浓度等于溶液中OH浓度,故溶液中由水电离出的H+浓度=c(OH)=1.0×1011molL1,故B正确;
C. b点时,溶液显示酸性,c(H+)>c(OH-),再根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)可知,则有c(CH3COO-)>c(Na+),故C正确;
D. 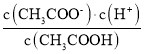 表示醋酸的电离平衡常数,而弱电解质电离平衡常数只与温度有关,由于b、d温度相同,平衡常数相等,但b、d两点c(H+)不同,则
表示醋酸的电离平衡常数,而弱电解质电离平衡常数只与温度有关,由于b、d温度相同,平衡常数相等,但b、d两点c(H+)不同,则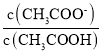 不相等,故D错误;
不相等,故D错误;
题目要求选不正确的,故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
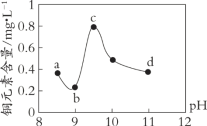
小学生10分钟应用题系列答案【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
【题目】为探究Na2SO3 溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下: 已知:![]() (橙色)+ H2O
(橙色)+ H2O![]() (黄色)+ 2H+
(黄色)+ 2H+
(1)配制溶液
序号 | 操作 | 现象 |
i | 配制饱和Na2SO3 溶液,测溶液的pH | pH 约为 9 |
ii | 配制0.05 mol·L1 的K2Cr2O7溶液,把溶液平均分成两份,向两份溶液中分别滴加浓硫酸和浓 KOH 溶液,得到pH=2 的溶液A 和 pH=8 的溶液B | pH=2的溶液A 呈橙色;pH=8的溶液 B 呈黄色 |
① 用化学用语表示饱和 Na2SO3 溶液 pH 约为 9 的原因:__。
(2)进行实验iii 和 iv:
序号 | 操作 | 现象 |
iii | 向 2 mL 溶液 A 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液变绿色(含Cr3+) |
iv | 向 2 mL 溶液 B 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液没有明显变化 |
② 用离子方程式解释 iii 中现象:__。
(3)继续进行实验v:
序号 | 操作 | 现象 |
v | 向 2 mL 饱和 Na2SO3 溶液中滴加 3 滴溶液A | 溶液变黄色 |
vi | 向 2 mL 蒸馏水中滴加 3 滴溶液A | 溶液变浅橙色 |
③ 实验 vi 的目的是__。
④ 用化学平衡移动原理解释 v 中现象:__。
⑤ 根据实验iii~v,可推测:Na2SO3 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__。
⑥ 向实验 v 所得黄色溶液中滴加__,产生的现象证实了上述推测。
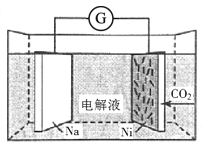
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
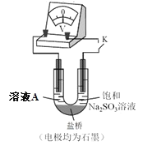
a.K 闭合时,电压为a。
b.向U 型管左侧溶液中滴加 3 滴浓硫酸后,电压增大了b。
⑦ 上述实验说明:__。
⑧ 有同学认为:随溶液酸性增强,溶液中O2 的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2 的存在不影响上述结论。该实验方案是__,测得电压增大了 d(d < b)。