题目内容
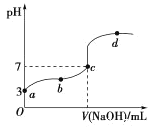
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A-)+c(HA)
D.c点溶液中:c(A-)>c(HA)
【答案】D
【解析】
室温下向![]() NaOH溶液中加入
NaOH溶液中加入![]() 的一元酸HA,a点酸碱的物质的量相等,二者恰好反应生成NaA,但溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;
的一元酸HA,a点酸碱的物质的量相等,二者恰好反应生成NaA,但溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;
要使混合溶液呈中性,则HA应该稍微过量,所以b点HA体积大于10mL,c点溶液中溶质为等物质的量浓度的NaA、HA,溶液呈酸性,说明HA电离程度大于![]() 水解程度;
水解程度;
A.a点时酸碱恰好中和,溶液![]() ,说明HA为弱酸,NaA溶液水解呈碱性,应为
,说明HA为弱酸,NaA溶液水解呈碱性,应为![]() ,选项A错误;
,选项A错误;
B.a点![]() 水解,促进水的电离,c点时HA过量,溶液呈酸性,HA电离出
水解,促进水的电离,c点时HA过量,溶液呈酸性,HA电离出![]() ,抑制水的电离,选项B错误;
,抑制水的电离,选项B错误;
C.![]() 时,
时,![]() ,由电荷守恒可知
,由电荷守恒可知![]() ,则
,则![]() ,选项C错误;
,选项C错误;
D.c点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于![]() 水解程度,则存在
水解程度,则存在![]() ,选项D正确;
,选项D正确;
答案选D。

【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
【题目】下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3 可作防火剂 |
B | 将 H2 在充满Cl2 的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2 化合生成HCl |
C | 将 SO2 通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2 具有氧化性 |
D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A.AB.BC.CD.D