题目内容
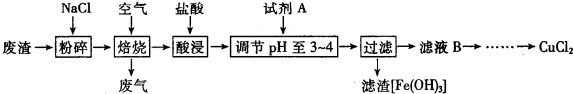
8.无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+3C12$\frac{\underline{\;\;△\;\;}}{\;}$2A1C13完成下列填空:
(1)写出B处烧瓶中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)C和D中盛有的试剂分别为饱和氯化钠溶液、浓硫酸.进行实验时应先点燃B (选填“B”或.“E”)处酒精灯
(3)G瓶的作用是使AlCl3冷凝、收集AlCl3,F装置的作用是吸收氯气及阻止空气中水蒸气进入G中
(4)将E中固体改为市售氣化铝(AlCl3.6H20),控制一定条件也能进行无水氣化铝的制 备,此时E中应通入HCl气体气体,作用是抑制AlCl3水解
(5)实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为4.
分析 该实验的原理是先通过发生装置制备氯气,然后通过浓硫酸干燥气体,干燥的氯气再与Al反应,最后收集制得的AlCl3.
(1)根据浓盐酸和二氧化锰反应生成氯化锰、氯气和水来书写;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢和水蒸气,然后根据除杂要求分析;先通过氯气排空装置中的空气,然后氯气与铝反应;
(3)根据在178℃升华,降温时能凝华以便收集;根据氯气的性质和碱石灰的成分判断;
(4)若用AlCl3•6H2O制备无水AlCl3,通入HCl是为了防止AlCl3水解.
(5)根据碱式氯化铝是氯化铝晶体的40%,列式计算.
解答 解:该实验的原理是先通过发生装置制备氯气,然后通过浓硫酸干燥气体,干燥的氯气再与Al反应,最后收集制得的AlCl3.
(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢,氯化氢极易溶于水,氯气难溶于饱和食盐水,所以选饱和食盐水除去氯化氢;因题中要求制取纯净的无水CuCl2,所以要除去氯气中混有的水蒸气,且不引进新的杂质、氯气也和该物质不反应,所以选浓硫酸;先通过氯气排空装置中的空气,然后氯气与铝反应,故答案为:饱和氯化钠溶液;浓硫酸;B;
(3)根据在178℃升华,降温时能凝华以便收集,所以装置G的作用为收集氯化铝;氯气有毒,污染环境,所以不能排空;碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应达到,所以可用碱石灰处理尾气;空气中有水蒸气,碱石灰还能吸收水蒸气,所以可作干燥剂,
故答案为:使AlCl3冷凝、收集AlCl3;吸收氯气及阻止空气中水蒸气进入G中;
(4)若用AlCl3•6H2O制备无水AlCl3,通入HCl是为了防止AlCl3水解,故答案为:HCl气体;抑制AlCl3水解;
(5)根据碱式氯化铝是氯化铝晶体的40%,列式241.5×40%=54+17n+213-35.5n,n=4,故答案为:4.
点评 本题考查了物质制备的实验过程分析判断,物质性质实验基本操作是解题关键,注意装置和试剂的作用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | b点酸的浓度小于a点酸的浓度 | |
| C. | b点溶液的导电性比c点溶液的导电性弱 | |
| D. | a点Kw的数值比c点Kw的数值小 |
| A. | 起始时,n(SO2)=2.5mol | B. | 起始时,c(O2)=0.5mol•L-1 | ||
| C. | 0~2min,v(SO3)=0.5mol•L-1•min-1 | D. | 0~2min,O2的转化率为50% |
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、SO42- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl-、HCO3- |
| A. | 原子半径的大小顺序:Y>Z>W>X | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z弱 | |
| C. | 化合物YX、ZX2、WX3中化学键类型相同 | |
| D. | 元素W的简单气态氢化物的热稳定性比X强 |
| A. | 空间利用率:Cu>Na>Po | B. | 熔点由高到低:金刚石>NaCl>K>CO2 | ||
| C. | 硬度由大到小:SiC>金刚石 | D. | 晶格能由大到小:NaF>NaCl>NaBr |
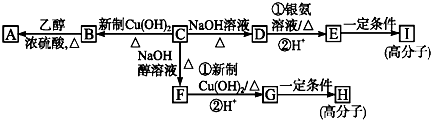
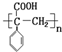 .
.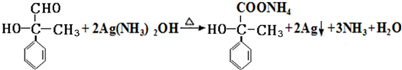 .
.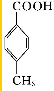 .
.