题目内容
18.下面的排序不正确的是( )| A. | 空间利用率:Cu>Na>Po | B. | 熔点由高到低:金刚石>NaCl>K>CO2 | ||
| C. | 硬度由大到小:SiC>金刚石 | D. | 晶格能由大到小:NaF>NaCl>NaBr |
分析 A.空间利用率:六方密堆积52%、面心立方74%、体心立方68%;
B.原子晶体中,晶体的熔点最高,分子晶体熔沸点最低;
C、都是原子晶体,化学键越强,硬度越大,原子半径越小,键长越大,化学键越强;
D、离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强.
解答 解:A.空间利用率:Po为六方密堆积52%、Cu为面心立方74%、Na为体心立方68%,所以空间利用率:Cu>Na>Po,故A正确;
B.原子晶体中,晶体的熔点最高,分子晶体熔沸点最低,离子晶体熔点大于金属钾,所以熔点高低顺序是:金刚石>NaCl>K>CO2,故B正确;
C、晶体中键长C-C<C-Si<Si-Si,故化学键强弱为C-C>C-Si>Si-Si,故硬度由大到小:金刚石>碳化硅,故C错误;
D、离子半径F-<Cl-<Br-,故离子键强度NaF>NaCl>NaBr,故晶格能NaF>NaCl>NaBr,故D正确;
故选C.
点评 本题考查了电离能、熔点、空间利用率等知识点,侧重选修三物质结构与性质的考查,把握元素周期律、熔点高低的影响因素、空间利用率大小等为解答的关键,题目难度中等.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
6.常见的有机反应类型有以下几种,其中能在有机物中引入羟基的反应类型有( )
①取代反应; ②加成反应;③消去反应;④酯化反应;⑤加聚反应;⑥缩聚反应;⑦氧化反应;⑧还原反应.
①取代反应; ②加成反应;③消去反应;④酯化反应;⑤加聚反应;⑥缩聚反应;⑦氧化反应;⑧还原反应.
| A. | ①②③④ | B. | ①②⑦⑧ | C. | ⑤⑥⑦⑧ | D. | ③④⑤⑥ |
13.由1L乙炔和乙烯的混合气体,在催化剂存在下与足量H2发生加成反应,消耗H21.2L,则原混合气体中乙烯和乙炔的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
3.下列说法正确的是( )
| A. | 淀粉和纤维素分子式均为(C6H10O5)n,它们水解的最终产物都是葡萄糖,因此淀粉和纤维素互为同分异构体 | |
| B. | 通过蒸馏法、电渗析法、离子交换法等可以实现海水的淡化 | |
| C. | 多糖、蛋白质、油脂均能水解,它们属于天然高分子化合物 | |
| D. | 石油的分馏、煤的干馏、煤的气化和液化均属于物理变化 |
10.化学反应都伴随着能量变化,下列反应中属于吸热反应的是( )
| A. | 制备水煤气的反应 | B. | 干冰气化 | ||
| C. | 工业合成氨 | D. | 生石灰吸收水 |
7.“两型”社会,提倡“低碳”生活,下列有关碳及碳的化合物叙述中正确的是( )
| A. | 二氧化碳是形成酸雨的主要气体 | |
| B. | 金刚石、石墨都是碳单质,两者碳原子的排列方式相同 | |
| C. | 一氧化碳含量增加会导致温室效应 | |
| D. | 大气中二氧化碳的消耗途径主要是绿色植物的光合作用 |

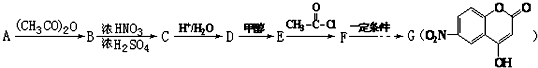

 .
.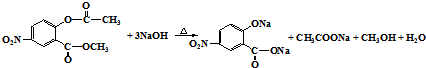 .
. 或
或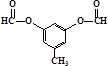 .
.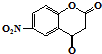 与G互为同分异构体
与G互为同分异构体