题目内容
12. 某化学研究小组在实验室中按下列步骤模拟铝表面“钝化”的产生过程.
某化学研究小组在实验室中按下列步骤模拟铝表面“钝化”的产生过程.(1)把铝片浸入热的16%的NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜的离子方程式Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O.
(2)按如图组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:
阳极:2Al-6e-+3H2O=6H++Al2O3;
阴极:6H++6e-=3H2↑.
(3)断开电路,取出铝片,用质量分数为1%的稀氨水中和表面的酸液,再用水冲洗干净,反应离子方程式NH3•H2O+H+=NH4++H2O.
分析 (1)铝表面有氧化铝,氧化铝是两性氧化物溶于氢氧化钠溶液中;
(2)依据装置图分析铝接电源正极在电解池中 做阳极失电子生成氧化铝,溶液中氢离子在阴极得到电子生成氢气;
(3)铝表面主要是稀硫酸溶液.
解答 解:(1)铝表面有氧化铝,氧化铝是两性氧化物溶于氢氧化钠溶液中反应生成四羟基合铝酸钠或偏铝酸钠,反应的离子方程式为:Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O
(2)装置图分析铝接电源正极在电解池中 做阳极失电子生成氧化铝,电极反应为:2Al-6e-+3H2O=6H++Al2O3;溶液中氢离子在阴极得到电子生成氢气,电极反应为:6H++6e-=3H2↑;
故答案为:2Al-6e-+3H2O=6H++Al2O3;6H++6e-=3H2↑;
(3)用1%稀氨水中和表面的酸液,是和稀硫酸发生的反应,反应离子方程式为:NH3•H2O+H+=NH4++H2O;
故答案为:NH3•H2O+H+=NH4++H2O.
点评 本题考查铝及其化合物性质的应用,原电池、电解池原理分析判断,电极反应书写方法,分析题干信息是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列气体的排放不会造成酸雨的是( )
| A. | SO2 | B. | NO | C. | NO2 | D. | CO2 |
3.以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体(如H2、CO等)时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2.
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体(如H2、CO等)时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | ①②③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 全部 |
20.火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2,下列说法正确的是( )
| A. | 每转移l.2 mol电子,有0.2mol硫被氧化 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1molCu2S,有4mol硫被氧化 | |
| D. | SO2只是氧化产物 |
17.金属在人类社会的发展进程中起着重要的作用.下列有关金属及其化合物的说法正确的是( )
| A. | Fe、Mg.Al均能与空气中的氧气反应在表面生成致密的氧化膜,对内层金属有保护作用 | |
| B. | Fe在高温下能与水蒸气反应,Fe被氧化生成Fe2O3,H2O被还原生成H2 | |
| C. | 鉴别Na2CO3和NaHCO3溶液可向两种溶液中加入Ba(OH)2溶液,产生沉淀的就是Na2CO3 | |
| D. | Al与NaOH溶液的反应中,NaOH既不是氧化剂又不是还原剂 |
4.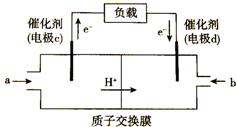 (1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(2)若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液,
电解一段时间后,两极收集到相同体积(相同条件)的气体,(忽略溶液体积的变化及电极产物可能存在的溶解现象)则整个电解过程中阳极发生反应的电极反应式为2Cl --2e-=Cl2↑,4OH--4e-=2H2O+O2↑.
 (1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.(2)若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液,
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
1.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO.其过程如:mCeO2$→_{①}^{太阳能}$(m-x)CeO2•xCe+xO2,(m-x)CeO2•xCe+xH2O+xCO2$→_{②}^{900℃}$mCeO2+xH2+xCO.下列说法不正确的是( )
| A. | 该过程中CeO2需要不断补充 | |
| B. | 该过程实现了太阳能向化学能的转化 | |
| C. | 二氧化铈(CeO2)是该反应的催化剂 | |
| D. | 该反应的副产物是O2 |
