题目内容
15.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )| A. | NaWO是漂白粉的有效成分 | |
| B. | 原子半径由小到大的顺序:X<Y<Z<W | |
| C. | 室温下,0.1mol/L W的气态氢化物的水溶液的pH>1 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
分析 X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y为Al元素;Z原子的最外层电子数是次外层电子数的一半,Z为Si元素,X与Z位于同一主族,则X为C元素;Y、Z、W原子的最外层电子数之和为14,则W的最外层电子数为14-3-4=7,且原子序数最大,W为Cl元素.
解答 解:X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y为Al元素;Z原子的最外层电子数是次外层电子数的一半,Z为Si元素,X与Z位于同一主族,则X为C元素;Y、Z、W原子的最外层电子数之和为14,则W的最外层电子数为14-3-4=7,且原子序数最大,W为Cl元素.
A.NaClO是漂白液的有效成分,漂白粉的有效成分为Ca(ClO)2,故A错误;
B.同周期元素从左到右元素的原子半径逐渐减小,一般电子层越多原子半径越大,则子半径由小到大的顺序为X(C)<W(Cl)<Z(Si)<Y(Al),故B错误;
C.W的气态氢化物为HCl,溶于水形成盐酸,HCl是强电解质,在溶液中完全电离,室温下,0.1 mol/L 盐酸溶液的pH=1,故C错误;
D.Al在高温下可以与氧化铁发生铝热反应,置换出铁,故D正确;
故选D.
点评 题中从常见元素化合物的性质入手考查,是一道位置结构性质综合考查学生分析能力题目,注意从物质的性质作为推断题的突破口,注意常见既能与盐酸反应也能与NaOH溶液反应的物质,难度中等.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
6.下列化合物的1H-NMR谱图中吸收峰数目正确的是( )
| A. | CH3CH2CH2CH3(3组) | B. | CH2═CH-CH2CH3(2组) | ||
| C. | 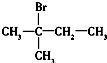 (4组) (4组) | D. | 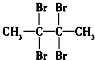 (1组) (1组) |
3.以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体(如H2、CO等)时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2.
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体(如H2、CO等)时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | ①②③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 全部 |
10.下列反应的离子方程式书写正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:2 AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| C. | 向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| D. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═H2O+BaCO3↓ |
20.火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2,下列说法正确的是( )
| A. | 每转移l.2 mol电子,有0.2mol硫被氧化 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1molCu2S,有4mol硫被氧化 | |
| D. | SO2只是氧化产物 |
4.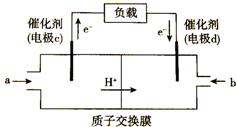 (1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(2)若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液,
电解一段时间后,两极收集到相同体积(相同条件)的气体,(忽略溶液体积的变化及电极产物可能存在的溶解现象)则整个电解过程中阳极发生反应的电极反应式为2Cl --2e-=Cl2↑,4OH--4e-=2H2O+O2↑.
 (1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.(2)若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液,
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |