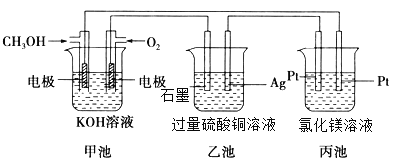
题目内容
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 已知酸性![]() ,物质的量浓度相等的NaF与
,物质的量浓度相等的NaF与![]() 溶液中:c
溶液中:c![]()
B. 0.lmol·L-1的NaHX溶液pH为4,该溶液中: ![]()
C. 氯水中: ![]()
D. 25°C时,pH=8的![]() 溶液中,
溶液中,![]() 约为10-6mol·L-1
约为10-6mol·L-1
【答案】D
【解析】
A、HF、CH3COOH都是弱酸,所以NaF与CHCOOK都是强碱弱酸盐,由于酸性HF>CH3COOH,所以根据盐的水解规律:有弱才水解,越弱越水解,谁强显谁性,水解程度CH3COO->F-,n(NaF)=n(CH3COOK),水解程度越大,剩余离子的浓度就越小,所以c(K+) - c(CH3COO-) > c(Na+)-c(F-),选项A错误;
B、0.lmol·L-1的NaHX溶液pH为4,溶液显示酸性,阴离子HX-的电离程度大于其水解程度,即c(X2-)>c(H2X),所以离子浓度大小顺序是:c(HX-)>c(X2-)>c(H2X)>c(H+)>c(OH-),选项B正确;
C.氯气不能完全溶解于水中,1体积的水大约溶解2体积的氯气,则c(Cl2 )>2[c(ClO -)+c(Cl -)+c(HClO)],选项C错误;
D.25°C时,pH=8的CH3COONa溶液中醋酸根离子水解,CH3COO-+H2OCH3COOH+OH-,由水电离出的c(OH-)=![]() =10-6molL-1,选项D正确;
=10-6molL-1,选项D正确;
答案选D。

【题目】已知:反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在不同的温度下的平衡常数分别为:
CO2(g)+H2(g)在不同的温度下的平衡常数分别为:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
k | 1.67 | 1.11 | 1.00 | 0.60 |
下列有关叙述不正确的是
A. 该反应平衡常数表达式为K=[c(CO2)·c(H2)]/[c(CO)·c(H2O)]
B. 该反应的逆反应是吸热反应
C. 830℃时,向恒容密闭容器中加入CO2 和H2各1mol,当测得CO2 的物质的量为0.4mol时,反应处于平衡状态
D. 若某温度下该反应中各物质的平衡浓度符合关系式:[c(CO2)/3c(CO)]=[c(H2O)/5c(H2)],则该温度是1000 C