题目内容
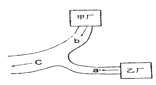
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是

A. 当K断开时,B装置锌片溶解,有氢气产生
B. 当K闭合后,C装置可作为电镀池装置
C. 当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
D. 当K闭合后,A、B装置中pH变大,C、D装置中pH不变
【答案】C
【解析】
根据装置可判断,B装置是原电池,其中锌是负极,铜是正极,A、C、D是电解池。A、当K断开时,B装置锌片直接与稀硫酸反应,锌溶解,有氢气产生,选项A正确;B、当K闭合后,B装置是原电池,C装置铜电极连接正极为阳极铜失电子产生铜离子,银电极连接负极为阴极铜离子得电子产生铜单质,可作为电镀池装置,选项B正确;C、当K闭合时,A装置中的铁与负极相连,做阴极,铁被保护,选项C错误; D、当K闭合后,A装置是电解池,反应中有氢氧化钠生成,pH变大。B装置是原电池,氢离子放电,因此溶液的pH变大,C装置相当于电镀,D装置是粗铜的精炼,因此C、D装置中 pH不变,选项D正确。答案选C。

【题目】金属加工前常用盐酸对金属表面氧化物进行清洗,会产生酸洗废水。pH在2左右的某酸性废水含铁元素质量分数约3%,其他金属元素如铜、镍、锌浓度较低,综合利用酸洗废水可制备三氯化铁。制备过程如下:

相关金属离子生成氢氧化物沉淀的pH如下表:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 1.5 | 4.2 | 7.1 | 5.4 |
沉淀完全的pH | 3.7 | 6.7 | 9.2 | 8.0 |
回答下列问题:
(1)“中和”时调节pH至________,有利于后续制备得纯度较高的产品。
(2)处理酸洗废水中和后的滤渣,使铁元素浸出。按照不同的固液比投入“过滤”后滤渣和工业盐酸进行反应的铁浸出率如图所示,实际生产中固液比选择1.5∶1的原因是__________________。

(3)写出“氧化”中发生反应的离子方程式:____________________________________。
(4)“酸溶”后需根据溶液中Fe2+含量确定氧化剂的投入量。用K2Cr2O7标准溶液测定Fe2+(Cr2O![]() 被还原为Cr3+)的含量,该反应离子方程式为____________________________。
被还原为Cr3+)的含量,该反应离子方程式为____________________________。
(5) 将三氯化铁溶液在一定条件下________、________、过滤、洗涤、在氯化氢气氛中干燥得FeCl3·6H2O晶体,在实验室过滤装置中洗涤固体的方法是___________________。